|
АКТИВНОСТЬ термодинамическая, величина, позволяющая представлять
в удобной для практич. использования форме концентрац. зависимость хим.
потенциалов компонентов реального р-ра. С помощью этой величины можно применять
к реальному р-ру термодинамич. соотношения, относящиеся к идеальному р-ру,
если заменить в них концентрации активностями. Отношение А. компонента
к его концентрации наз. коэф. активности.
Хим. потенциал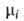 и
активность а,- i-того компонента р-ра по определению связаны соотношением: и
активность а,- i-того компонента р-ра по определению связаны соотношением:
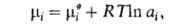
где R-газовая постоянная, T - т-ра,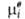 -хим.
потенциал компонента в определенным образом выбранном стандартном состоянии.
Значения -хим.
потенциал компонента в определенным образом выбранном стандартном состоянии.
Значения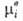 зависят
только от T и давления р; ai - ф-ция Т, р и состава
р-ра. Т. обр., введение понятия А. позволяет разделить выражение для хим.
потенциала на две части: постоянную при данных Т и р зависят
только от T и давления р; ai - ф-ция Т, р и состава
р-ра. Т. обр., введение понятия А. позволяет разделить выражение для хим.
потенциала на две части: постоянную при данных Т и р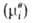 и
зависящую от состава (RTlnai). Это разделение условно,
поскольку численное значение ai зависит от выбора стандартного
состояния. В стандартном состоянии ai = 1. и
зависящую от состава (RTlnai). Это разделение условно,
поскольку численное значение ai зависит от выбора стандартного
состояния. В стандартном состоянии ai = 1.
Для компонентов жидких р-ров неэлектролитов чаще всего в кач-ве стандартного
выбирают состояние чистой жидкости при т-ре и давлении р-ра с хим. потенциалом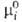 (Т, р). Тогда
(Т, р). Тогда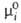 = =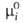 при
мольной доле Ni = 1, активность ai
и коэф. активности при
мольной доле Ni = 1, активность ai
и коэф. активности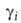 =ai/Ni
равны единице. В р-ре =ai/Ni
равны единице. В р-ре
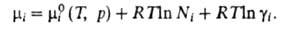
Если р-р ведет себя как идеальный, то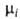 ид
= ид
=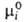 + RT1nNi.
Знак разности + RT1nNi.
Знак разности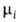 — —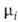 нд
= RTn нд
= RTn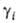 определяет
знак отклонения поведения реального р-ра от идеального: при определяет
знак отклонения поведения реального р-ра от идеального: при
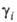 > 1 отклонение
от идеальности положительно, при > 1 отклонение
от идеальности положительно, при
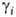 < 1
- отрицательно. Выбор чистых в-в в качестве стандартных состояний для всех
компонентов р-ра наз. симметричной нормировкой А.; ее применяют в тех случаях,
когда все компоненты р-ра рассматриваются как равноправные. < 1
- отрицательно. Выбор чистых в-в в качестве стандартных состояний для всех
компонентов р-ра наз. симметричной нормировкой А.; ее применяют в тех случаях,
когда все компоненты р-ра рассматриваются как равноправные.
При т. наз. несимметричной нормировке А. стандартным состоянием для
р-рителя (компонент 1) служит чистая жидкость 1, как и при симметричной
нормировке,
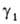 = 1 при
Ni = 1. Для растворенного в-ва (компонент 2) принимают,
что его А. совпадает с концентрацией и коэф. активности равен единице в
предельно разб. р-ре. Иначе говоря, стандартное состояние для этого компонента
выбирают т. обр., чтобы = 1 при
Ni = 1. Для растворенного в-ва (компонент 2) принимают,
что его А. совпадает с концентрацией и коэф. активности равен единице в
предельно разб. р-ре. Иначе говоря, стандартное состояние для этого компонента
выбирают т. обр., чтобы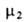 было равно его хим. потенциалу
было равно его хим. потенциалу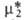 в гипотетич. р-ре единичной концентрации, в к-ром коэф. активности равен
единице. Стандартный хим. потенциал
в гипотетич. р-ре единичной концентрации, в к-ром коэф. активности равен
единице. Стандартный хим. потенциал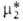 определяют линейной экстраполяцией к единичной концентрации зависимости
типа
определяют линейной экстраполяцией к единичной концентрации зависимости
типа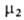 = =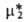 +
RTlnN2, к-рая отвечает Генри закону и выполняется
лишь при достаточно малых N2. В зависимости от способа
выражения концентрации (мольная доля N2, молярность с,
моляльность m) стандартный хим. потенциал растворенного в-ва принимает
разл. значения; соотв. и А. растворенного в-ва имеет разл. значения: +
RTlnN2, к-рая отвечает Генри закону и выполняется
лишь при достаточно малых N2. В зависимости от способа
выражения концентрации (мольная доля N2, молярность с,
моляльность m) стандартный хим. потенциал растворенного в-ва принимает
разл. значения; соотв. и А. растворенного в-ва имеет разл. значения:
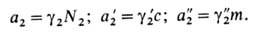
Для р-ров электролитов применяют, как правило, несимметричную нормировку
А. компонентов, но с учетом элек-тролитич. диссоциации. А. сильного электролита,
диссоциирующего на v1 катионов и v2
анионов в р-ре моляльности т, представляют соотношением: a =
v1vlv2v2(m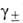 )v,
где v = = v1 + v2 и )v,
где v = = v1 + v2 и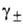 -т.
наз. средний ионный коэф. активности; -т.
наз. средний ионный коэф. активности;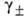 -> 1 при m->0. Аналогично м.б. записана А. и при др. способах выражения
концентрации.
-> 1 при m->0. Аналогично м.б. записана А. и при др. способах выражения
концентрации.
А. всех компонентов р-ра связаны между собой Гиббса-Дюгема уравнением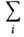 Nidlnai,
= 0 (при постоянных Т и р). Nidlnai,
= 0 (при постоянных Т и р).
Это позволяет рассчитывать А. одного из компонентов по данным о концентрац.
зависимости всех остальных, а также проверять найденные к.-л. образом значения
А. всех компонентов на их термодинамич. согласованность.
Эксперим. определение А. компонентов р-ра возможно разл. методами, напр.
криоскопией, осмометриеп. А. летучего компонента обычно определяют
по измерениям давления пара, учитывая связь А. с летучестью-, если
fi и f 0i -летучести i-того
компонента в р-ре и в стандартном состоянии соотв., то ai
-fi/f0i. Для системы, в к-рой пар
ведет себя как идеальный, ai- = pi/p0i,
где р,-парциальное давление компонента над р-ром, р,-- давление пара чистой
жидкости.
Характер концентрац. зависимости А. в-ва в том или ином р-ре определяется
особенностями межмолекулярных взаимодействий в нем. Теоретич. расчет
А. возможен методами статистич. термодинамики; для практич. расчетов широко
используют приближенные модели, напр., регулярного р-ра, атермич. р-ра,
групповые модели (см. Растворы неэлектролитов). Для сильных электролитов
А. в первом приближении описывается теорией Дебая - Хюккеля (см. Растворы
электролитов). Определение активностей и коэф. активности в-в важно
при расчетах фазовых и хим. равновесий. Так, общее условие фазового равновесия,
заключающееся в равенстве хим. потенциалов данного компонента в каждой
из фаз, отвечает условию равенства А. этого компонента, если они определены
по отношению к одному и тому же стандартному состоянию.
Понятия А. и коэф. активности введены Г. Льюисом в 1907.
===
Исп. литература для статьи «АКТИВНОСТЬ»: Карапетьянц М.Х., Химическая термодинамика, 3 изд., М.,
1975; Робинсон Р., Стоке Р., Растворы электролитов, пер. с англ., М„ 1963;
Термодинамика разбавленных растворов неэлектролитов, Л., 1982.
Страница «АКТИВНОСТЬ» подготовлена по материалам химической энциклопедии.
|

