|
ГАЛОГЕНАНТРАХИНОНЫ.
Практич. применение нашли моно-, нек-рые ди-, три- и тетрахлорантрахиноны.
Г.-кристаллы от бледно-желтого до желтого цвета (см. табл.); не раств. в воде,
трудно раств. в спирте, раств. в нитробензоле, уксусной к-те, пиридине, хлороформе,
конц. H2SO4 (с углублением окраски); см. Цветность
органических соединений.
СВОЙСТВА ГАЛОГЕНАНТРАХИНОНОВ
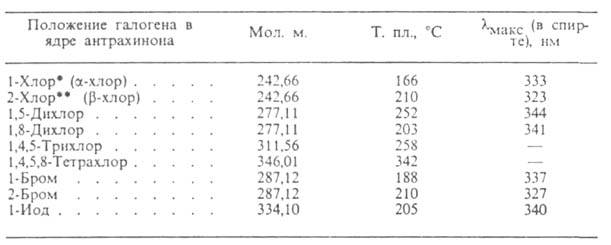
* Ниж. КПВ 79 г/м3.
** Ниж. КПВ 10,4 г/см3.
Атомы
галогена Г. замещаются на амино-, гидрокси-, алкокси-, арилокси-, арилтиогруппы
в более мягких условиях, чем галогены др. ароматич. соединений, причем
атомы галогена в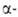 положениях
замещаются легче, чем в положениях
замещаются легче, чем в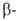 положениях,
а атомы иода и брома легче, чем хлора. Благодаря этому из Г. получают разнообразные
замещенные антрахинона, имеющие пром. и препаративное значение. 1-Г., 1,5-дигалогенантрахинон
(1,5-Д.), 1,4,5-тригалогенантрахи-нон и 1,4,5,8-тетрагалогенантрахинон
(1,4,5,8-Т.) при взаимод. с аминоантрахинонами в присут. Си или ее солей
и щелочных агентов (карбонатов и ацетатов щел. металлов, MgO) образуют
соотв. моно-, ди-, три- и тетраантримиды (напр., 1,5-диантримид; ф-ла I)-кубовые
красители и промежут. продукты в синтезе фталоилкарбазолов (см. Полициклические
кубовые красители). положениях,
а атомы иода и брома легче, чем хлора. Благодаря этому из Г. получают разнообразные
замещенные антрахинона, имеющие пром. и препаративное значение. 1-Г., 1,5-дигалогенантрахинон
(1,5-Д.), 1,4,5-тригалогенантрахи-нон и 1,4,5,8-тетрагалогенантрахинон
(1,4,5,8-Т.) при взаимод. с аминоантрахинонами в присут. Си или ее солей
и щелочных агентов (карбонатов и ацетатов щел. металлов, MgO) образуют
соотв. моно-, ди-, три- и тетраантримиды (напр., 1,5-диантримид; ф-ла I)-кубовые
красители и промежут. продукты в синтезе фталоилкарбазолов (см. Полициклические
кубовые красители).
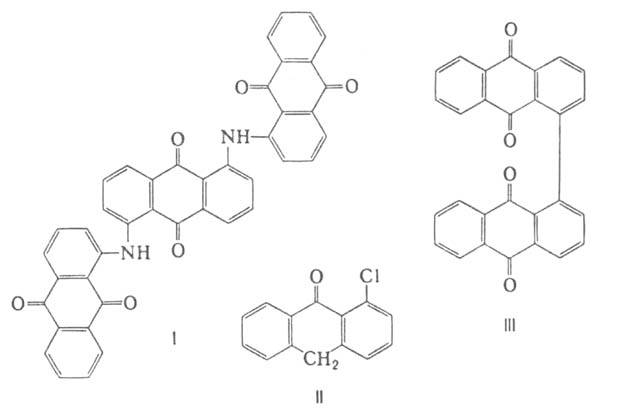
2-Г.
при аммонолизе под давлением и 200-205 °С образуют 2-аминоантрахинон-промежут.
продукт в синтезе кубовых красителей. 1,5-Д. и 1,8-Д. реагируют с л-толуидином,
превращаясь в соответствующие ди-п-толуидиноантрахиноны- жирорастворимые
фиолетовые красители. 1-Хлорантрахинон при восстановлении А1 в H2SO4
или Sn и НС1 в СН3СООН образует соотв. 1-хлорантрон (ф-ла II)
или 4-хлорантрон; в кипящем нитробензоле в присут. порошка Си превращ.
в 1,Г-диантрахинонил (III); при нитровании образует 4-нитро-1-хлорантрахинон;
при сульфировании 20%-ным олеумом при 160°С-смесь антрахинон-6-. и антрахинон-7-сульфокислот.
Нитрование 1,5- и 1,8-дихлорантрахинонов приводит соотв. к 4,8-динитро-1,5-дихлор-и
4,5-динитро-1,8-дихлорантрахинонам. 2-Г. при щелочном плавлении в присут.
окислителя (KNO3) превращ. в 1,2-дигидроксиантрахинон (ализарин).
Сульфирование
1,5- или 1,8-дихлорантрахинонов в присут. Hg дает соотв. 1,5-дихлорантрахинон-4,8-
и 1,8-дихлорантрахинон-4,5-дисульфокислоты, применяемые в синтезе 1,4,5,8-Т.
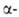 Замещенные 1-хлор-, 1,5- и 1,8-дихлорантрахиноны в пром-сти и лаборатории
получают взаимод. соотв. моно-или дисульфокислот антрахинона с NaClO3
или газообразным С12 в среде разб. НС1 в присут. NH4C1
при 95-100 °С. 1,4,5-Трихлорантрахинон получают хлорированием антрахинон-1-сульфокислоты
газообразным С12 в H2SO4 до 5,8-дихлорантрахинон-1-сульфокислоты
с послед. заменой сульфогруппы на хлор таким же способом, каким получают
1-хлорантрахинон:
Замещенные 1-хлор-, 1,5- и 1,8-дихлорантрахиноны в пром-сти и лаборатории
получают взаимод. соотв. моно-или дисульфокислот антрахинона с NaClO3
или газообразным С12 в среде разб. НС1 в присут. NH4C1
при 95-100 °С. 1,4,5-Трихлорантрахинон получают хлорированием антрахинон-1-сульфокислоты
газообразным С12 в H2SO4 до 5,8-дихлорантрахинон-1-сульфокислоты
с послед. заменой сульфогруппы на хлор таким же способом, каким получают
1-хлорантрахинон:
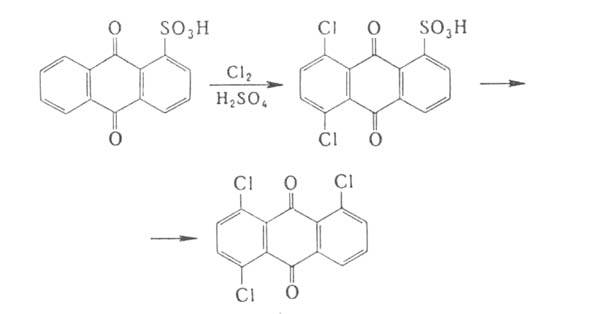
1,4,5,8-Тетрахлорантрахинон
синтезируют взаимод. 1,8-дихлорантрахинон-1,5- или 4,5-дихлорантрахинон-1,8-дисульфокислот
с КС1О3 при кипячении в среде разб. НС1 или непосредственно
хлорированием антрахинона в олеуме.
2-Хлорантрахинон
получают конденсацией по Фриделю-Крафтсу фталевого ангидрида с хлорбензолом
в присут. А1С13 при 45-50 °С с послед. разложением реакц. комплекса
водой, отгонкой хлорбензола и фильтрацией 4-хлор-бензоилбензойной к-ты,
к-рую подвергают циклизации в 15%-ном олеуме при 130°С. Этим способом в
лаборатории м. б. получены другие Г. конденсацией соответствующих хлорфталевых
ангидридов с бензолом или галогенбензолами. Напр., 1,4,5-трихлорантрахинон
синтезируют р-цией 3-хлорфталевого ангидрида с n-дихлорбензолом с послед.
циклизацией.
1- и
2-Бромантрахиноны синтезируют только в лаборатории. Первый получают взаимод.
антрахинон-1-сульфокислоты с Вr2 при 200-220 °С, второй - р-цией
Зандмейера из диазотированного 2-аминоантрахинона, а также аналогично 2-хлорантрахинону
- из фталевого ангидрида и бром-бензола с послед. циклизацией. 1-Иодантрахинон
получают взаимод. диазотированного 1-аминоантрахинона с KI.
===
Исп. литература для статьи «ГАЛОГЕНАНТРАХИНОНЫ»:
Ворожцов
Н. Н., Основы синтеза промежуточных продуктов и красителей, 4 изд., М.,
1955; Эфрос Л. С, Горелик М. В., Химия и технология промежуточных продуктов,
Л., 1980. С. И. Попов.
Страница «ГАЛОГЕНАНТРАХИНОНЫ» подготовлена по материалам химической энциклопедии.
|

