|
ГАЛОГЕНОНИЕВЫЕ
СОЕДИНЕНИЯ, содержат положительно заряженный атом галогена (С1, Вг,
I), связанный ковалентно с двумя орг. радикалами и ионной связью с анионом,
напр.
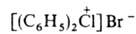
, 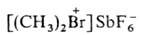 . Относятся к ониевым соединениям. наиб. доступны
и лучше всего изучены иодониевые соединения.
Известны след, типы Г. с.
1. Ароматич.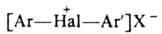 , где X-анион сильной к-ты, Аr и Аr'-одинаковые или разные ароматич. радикалы,
гетероциклич. радикалы ароматич. характера (тиснил, Hal = I, Вr; фурил,
индолил, Hal = I) или элементоорг. радикалы (12-карборанил, Hal = I, Br,
C1).
, где X-анион сильной к-ты, Аr и Аr'-одинаковые или разные ароматич. радикалы,
гетероциклич. радикалы ароматич. характера (тиснил, Hal = I, Вr; фурил,
индолил, Hal = I) или элементоорг. радикалы (12-карборанил, Hal = I, Br,
C1).
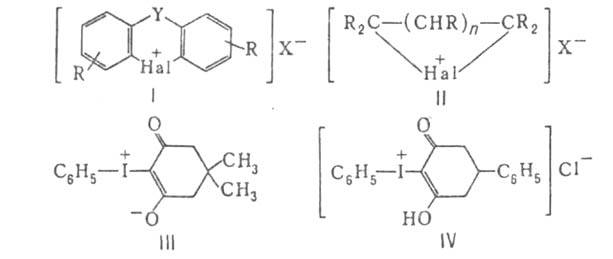
2. Ароматические
с атомом галогена в цикле (ф-ла I), где R = Н или к.-л. заместитель; X
= анион; Y = —О—, -NH-, -S-, -SO- -S02-, -СО-, -(СН2)n-
(п
=0, 1, 2, 3),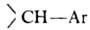 и др.
и др.
3. Алифатич.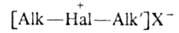 и жирноароматич.
и жирноароматич.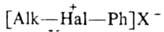 , где Alk и Alk'-одинаковые или разные, Х-чаще всего SbF6-.
, где Alk и Alk'-одинаковые или разные, Х-чаще всего SbF6-.
4. Алифатические
с атомом галогена в цикле (ф-ла И), где п = 0-3; R = Н, Alk; X =
SbF6-.
5. Цодониевые
соед., содержащие ненасыщ. радикалы:
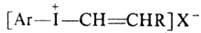 ,
,
где R = С1 (транс), Ph (транс), СН3
(цис и транс),
н-С8Н17, PhCH2,
Н; X = Hal, BF4;
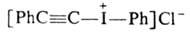 и
и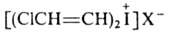 (транс). (транс).
6. Иодониевые
соед. из дикетонов,
напр. ф-лы III и IV. дикетонов,
напр. ф-лы III и IV.
Свойства.
Г. с.-твердые солеобразные в-ва с высокими т-рами плавления (120-250 °С);
раств. в полярных р-рителях (ацетон, CH3NO2, C6H5NO2,
CH3CN, ДМФА и др.), не раств. в эфире и углеводородах. Ароматич.
Г. с. с анионами NO3-, HCOO-, AcO-,
HSO4- обычно раств. в воде, с анионами Br-,
I-, HgB3-, PtCl62-
, как правило, плохо раств. в воде. Алифатич. Г. с. могут существовать
только с комплексными анионами. Они сравнительно устойчивы лишь в р-рах
(обычно в жидком SO2) при т-рах не выше — 40 °С. В твердом виде
выделено лишь неск. соединений, напр.
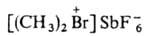
устойчивый
в отсутствие влаги (т. разл. 110°C. Гидроксиды дифенилгалогенониев,
существующие только в р-рах,-сильные основания, подобные орг. основаниям
аммония и сульфония. При нагр. Г. с. распадаются с образованием галогенопроизводных,
напр.:
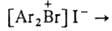 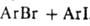 .
.
Термич. стойкость Г. с. резко убывает в ряду:
Алифатич.
Г. с.-сильные алкилирующие агенты, передающие алкил-катион практически
любому орг. соед. кислорода, азота или серы, имеющему неподеленные пары
электронов на гетероатоме, напр.:
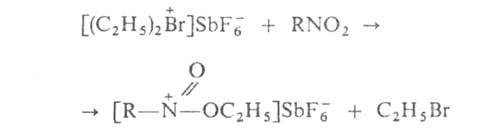
Соед.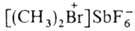 , в отличие от третичных алифатич. оксониевых соед., метилирует даже RHal
и ArHal с образованием новых Г. с.
, в отличие от третичных алифатич. оксониевых соед., метилирует даже RHal
и ArHal с образованием новых Г. с.
Диарилгалогенониевые
соед. - хорошие арилирующие агенты, способные как к гомолитич., так и гетеролитич.
арилированию; их катионы легко арилируют разл. нуклеофилы, напр.:
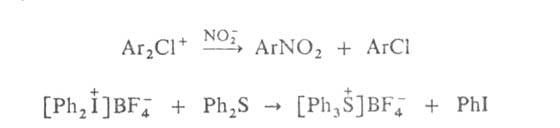
Подобно
ароматич. солям диазония галогениды ароматич. Г. с. образуют металлоорг.
соед. с Hg, Sb, Те, Sn, Tl, Pb, Bi, напр.:
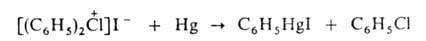
С галогенидами
тяжелых металлов ароматич. Г. с. дают двойные соли, при разложении к-рых
порошками металлов образуются металлоорг. соед. (как и по р-ции Несмеянова):
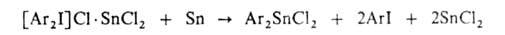
Соли
дифенилгалогенониев легко нитруются нитрующей смесью с образованием ди-мета-нитропроизводных.
Скорость нитрования заметно убывает в ряду:
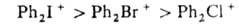
Получение
и применение. Ароматич. иодониевые соед. обычно получают след. методами:
1. Взаимод.
АrIС12 (или IС13) с ароматич. соед. Hg или Sn, напр.:
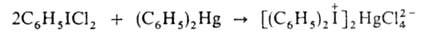
Этим
методом были получены и иодониевые соед. с ненасыщ. радикалами, напр.:
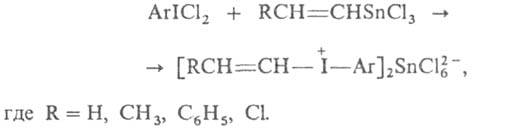
2. Конденсацией
аренов с АrIO или ArI(OAc)2 в присут. конц. H2SO4:
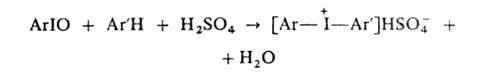
причем
АгЮ можно получать in situ из Arl и окислителя (K2S2O8,
BaO2, СН3СО3Н и др.).
3. Взаимод.
гидрокси(тозилокси)нодаренов с арилтриметилсиланами в инертном р-рителе:
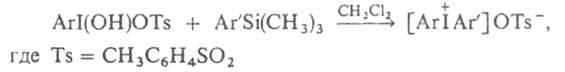
Аналогично
можно получить и любые арилалкенилиодониевые соли, напр.:
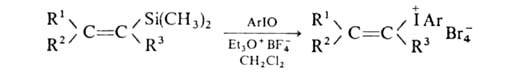
4. Действием
влажного оксида серебра или NaOH на эквимолярную смесь АrIO и АrIO2:
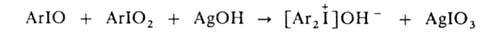
Все
ароматич. Г. с. получают нагреванием ароматич. диазосоединений с арилгалогенидами:
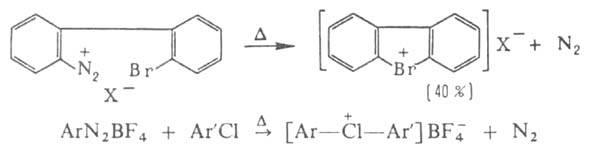
Несмотря
на низкие выходы (5-15%) целевого продукта, этот метод пока единственный
для получения ароматич. хлорониевых соединений.
Ароматич.
бромониевые соед. можно получать с выходом 50-95% низкотемпературной (
— 70 °С) конденсацией BrF3 или ArBrF2 (в присут.
CH3CN и Et2O*BF3) с аренами, а также с
Ar2Hg или с Ar4Sn, напр.:
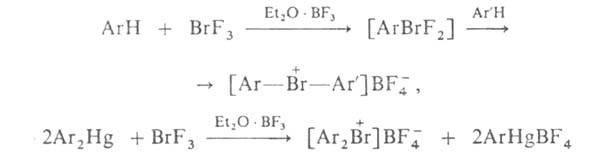
Алифатич.
Г. с. получают в атмосфере сухого азота, при полном исключении влаги, в
осн. двумя методами: а) взаимод. избытка моно- или дигалогеналкана с комплексом
SbF5*SO2, безводной фторсурьмяной к-той (HF*SbF5)
или с безводным AgSbF6 в жидком SO2 при т-рах от
— 60 до -78°С, напр.:
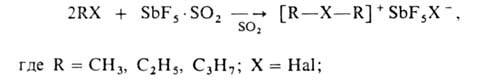
б) алкилированием
галогеналканов метил- или этилгексафторантимонатами в жидком SO2
при — 60 °С, например:
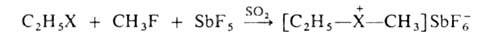
Г. с.
применяют в лаб. практике как алкилирующие и арилирующие агенты. Они обладают
широким спектром бактериостатич. действия.
===
Исп. литература для статьи «ГАЛОГЕНОНИЕВЫЕ»:
Реутов
О. А., Макарова Л. Г., Толстая Т.П., "Ж. орган, химии", 1969, т. 5, в.
9, с. 1521-38; Reutov О. A., Ptitsyna О. A., "Organometallic Reactions",
1972, v. 4, p. 73-162; Varvoglis A., "Synthesis", 1984, № 9, p. 709-26.
Т.П. Толстая.
Страница «ГАЛОГЕНОНИЕВЫЕ» подготовлена по материалам химической энциклопедии.
|

