|
ГИДРИДЫ, соединения водорода с металлами или менее электроотрицательными,
чем водород, неметаллами. Иногда к Г. относят соед. всех хим. элементов
с водородом. Различают простые, или бинарные, Г., комплексные (см., напр.,
Алюмогидриды, Борогидриды металлов)и Г. интерметаллич. соединений.
Для большинства переходных металлов известны также комплексные соед., содержащие
атом Н наряду с др. лигандами в координац. сфере металла-комплексообразователя.
Простые гидриды. Известны для всех элементов, кроме благородных
газов, платиновых металлов (исключение -Pd), Ag, Au, Cd, Hg, In, Tl. В
зависимости от природы связи элемента (Э) с водородом подразделяются на
ковалентные, ионные (солеобразные) и металлоподобные (металлические), однако
эта классификация условна, т. к. между разл. типами простых Г. резких границ
нет.
К ковалентным относят Г. неметаллов, Al, Be, Sn, Sb. Гидриды SiH4,
GeH4, SnH4, PH3, AsH3, SbH3,
H2S, H2Se, H2Te (см. табл. 1) и низшие
бороводороды-газы. Ковалентные Г. обладают высокой реакц. способностью.
Эффективный положит. заряд атома Э в молекуле возрастает в пределах одной
группы периодич. системы с увеличением его порядкового номера. Элементы
Si и Ge образуют высшие Г. общей ф-лы ЭnН2n +
2 (п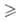 2),
стабильность к-рых быстро уменьшается с увеличением числа атомов Э. Гидриды
элементов подгруппы S хорошо раств. в воде (р-ры имеют кислую р-цию), подгруппы
Р-незначительно. Г. элементов подгруппы Si взаимод. с водой с образованием
ЭО2 и Н2. Все эти Г. раств. в неполярных или малополярных
орг. р-рителях. Ковалентные Г.-сильные восстановители. Легко вступают в
обменные р-ции, напр. с галогенидами металлов. При 100-300 °С (H2S
ок. 400 °С) разлагаются практически необратимо до Э и Н2. 2),
стабильность к-рых быстро уменьшается с увеличением числа атомов Э. Гидриды
элементов подгруппы S хорошо раств. в воде (р-ры имеют кислую р-цию), подгруппы
Р-незначительно. Г. элементов подгруппы Si взаимод. с водой с образованием
ЭО2 и Н2. Все эти Г. раств. в неполярных или малополярных
орг. р-рителях. Ковалентные Г.-сильные восстановители. Легко вступают в
обменные р-ции, напр. с галогенидами металлов. При 100-300 °С (H2S
ок. 400 °С) разлагаются практически необратимо до Э и Н2.
Табл. 1.-СВОЙСТВА ПРОСТЫХ КОВАЛЕНТНЫХ И ИОННЫХ ГИДРИДОВ
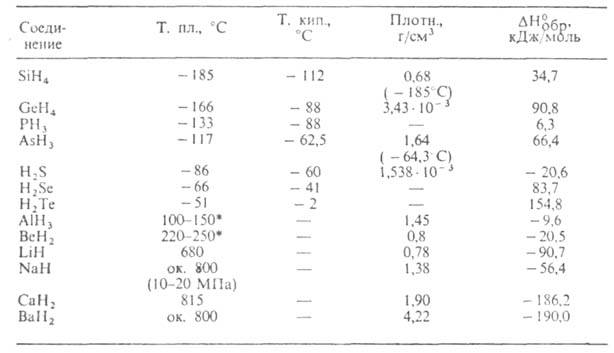
* Т-ра разложения.
Г. подгруппы фосфора получают р-цией ЭС13 с Li[AlH4]
в эфире при 25 °С; SiH4 и GeH4-взаимод. Мg2Э
с водой или с В2Н6 в жидком NH3; H2S,
H2Se и Н2Те-кислотным гидролизом сульфидов, селенидов
или теллуридов металлов (H2S-также взаимод. Н, и S). Все упомянутые
Г., особенно AsH3 и РН3, высокотоксичны. Гидриды
Ge, Si, As используют для получения полупроводниковых материалов. См. также
Мышьяка гидрид, Сероводород, Силаны, Фосфины.
Гидриды ВеН2 и А1Н3, существующие в полимерном
состоянии, а также крайне нестойкий термически Ga2H6
по природе хим. связи Э—Н близки к бороводородам: для них характерен дефицит
электронов, в связи с чем образование молекул или кристаллов происходит
с участием двухэлектронных трехцентровых мостиковых (Э—Н—Э) и многоцентровых
связей. Для этих Г. характерны очень высокие энтальпии сгорания. Они взаимод.
с водой, выделяя Н2. С донорами электронов, напр. с NR3,
PR3, образуют аддукты, с В2Н6 в среде
апротонных орг. р-рителей-соотв. Аl[ВН4]3 и Ве[ВН4]2.
Получают гидриды А1 и Be по р-циям:
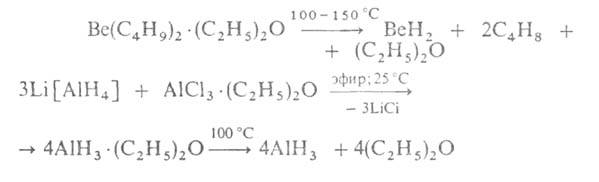
К ионным относят Г. щелочных и щел.-зем. металлов (кроме Mg). Эти соед.-структурные
аналоги соответствующих галогенидов. Представляют собой кристаллы, к-рые
в расплавл. состоянии проводят электрич. ток, причем Н2 выделяется
на аноде. Не раств. в орг. р-рителях, хорошо раств. в расплавах галогенидов
щелочных металлов. Обладают высокой хим. активностью, бурно реагируют с
О2 и влагой воздуха. Взаимод. с водой (напр., МН + Н2О
-> МОН + Н2) сопровождается выделением тепла. В эфире, диглиме,
ТГФ легко (особенно LiH и NaH) реагируют с галогенидами или гидридами В
и А1, образуя соотв. борогидриды М[ВН4]n и алюмогидриды
М[А1Н4]n. При 700-800°С восстанавливают оксиды до
металлов. С СО2 дают соли муравьиной к-ты. Взаимод. с N2,
напр. 3СаН2 + + N2->Ca3N2 +
ЗН2.
Получают ионные Г. обычно взаимод. Н2 с расплавом соответствующего
металла под давлением. Их используют в кач-ве сильных восстановителей (напр.,
для получения металлов из их оксидов или галогенидов, удаления окалины
с пов-стей изделий из стали и тугоплавких металлов). Многие Г.-источники
Н2, перспективное ракетное топливо. Дейтериды и тритиегидриды
- возможное горючее для ядерных реакторов. См. также Лития гидрид.
Гидрид Mg по св-вам и природе хим. связи занимает промежут. положение
между ковалентными и ионными Г.; кристаллы с решеткой типа ТiO2;
при высоких давлениях ( ~ 7 МПа) претерпевает полиморфные превращения.
С водой и водными р-рами к-т и щелочей MgH2 взаимод. с выделением
Н2, однако менее энергично, чем Г. щелочных и др. щел.-зем.
металлов. М. б. получен взаимод. Mg с Н2 при 200-250 °С и давлении
10 МПа (скорость р-ции мала) либо обменной р-цией MgHal2 с МН
или М [А1Н4], где М—Li, Na, в среде орг. р-рителя. Легко образуется
при гидрировании сплавов Mg, содержащих небольшие добавки РЗЭ и переходных
металлов, при 150-180°С и 1-5 МПа, причем р-ция обратима. В связи с этим
такие сплавы-перспективные хим. аккумуляторы Н2 для нужд малой
энергетики, металлургии и хим. технологии.
К металлоподобным относят Г. переходных металлов и РЗЭ. Формально такие
соед. могут рассматриваться как фазы внедрения водорода в металл. Их образованию
всегда предшествует адсорбция Н2 на пов-сти металла.
Адсорбированная молекула диссоциирует на атомы Н, в результате диффузии
к-рых в кристаллич. решетку происходит образование т.н.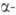 раствора
водорода в металле; процесс не сопровождается перестройкой кристаллич.
решетки. При достижении определенной концентрации Н2 в раствора
водорода в металле; процесс не сопровождается перестройкой кристаллич.
решетки. При достижении определенной концентрации Н2 в растворе
образуется собственно Г. металла растворе
образуется собственно Г. металла , как правило, стехиометрич. состава (МН3 для металлов III гр.,
МН2 для IV гр. и ванадия). Взаимод. Н2 с указанными
металлами (кроме Pd) всегда сопровождается перестройкой кристаллич. решетки.
Для описания природы хим. связи водорода с металлич. матрицей используют
представление о типе связи, промежуточном между ионной и металлической;
электроны водорода в большей или меньшей степени участвуют в формировании
зоны проводимости Г. По-видимому, вклад ионной составляющей связи М+
—Н- Наиб. велик для EuH2, YbH2 и тригидридов
лантаноидов и минимален для PdH0,6, а также для гидридов Mn,
Fe, Co, Ni, существующих при высоких давлениях Н2 и содержащих
менее одного атома Н на атом металла.
, как правило, стехиометрич. состава (МН3 для металлов III гр.,
МН2 для IV гр. и ванадия). Взаимод. Н2 с указанными
металлами (кроме Pd) всегда сопровождается перестройкой кристаллич. решетки.
Для описания природы хим. связи водорода с металлич. матрицей используют
представление о типе связи, промежуточном между ионной и металлической;
электроны водорода в большей или меньшей степени участвуют в формировании
зоны проводимости Г. По-видимому, вклад ионной составляющей связи М+
—Н- Наиб. велик для EuH2, YbH2 и тригидридов
лантаноидов и минимален для PdH0,6, а также для гидридов Mn,
Fe, Co, Ni, существующих при высоких давлениях Н2 и содержащих
менее одного атома Н на атом металла.
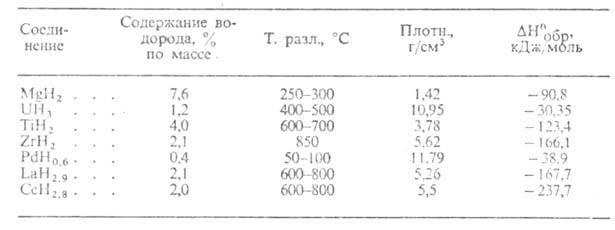
Металлоподобные Г. (см. табл. 2)-светло- и темно-серые кристаллы с металлич.
блеском, устойчивые на воздухе при комнатной т-ре. С О2, водой
и водяным паром реагируют медленно. М.б. получены взаимод. металла с Н2
при обычной т-ре или при нагр.; напр., TiH2 и LaH3
синтезируют при 150-200 °С. Получение Г. стехиометрич. состава в большинстве
случаев сопряжено со значит. трудностями из-за высокой чувствительности
гидрироваиия к наличию примесей в металле и особенно О2 и водяных
паров в Н2. Металлоподобные Г. ограниченно применяют в кач-ве
источников Н2 высокой чистоты (используемых, напр., в топливных
элементах) и для поглощения Н2 из газовых смесей. Гидриды Pd-катализаторы
гидрирования, изомеризации, орто- и парапревращения Н2.
Табл. 2.-СВОЙСТВА МЕТАЛЛОПОДОБНЫХ ГИДРИДОВ
Гидриды интерметаллических соединений. Содержат обычно атомы
РЗЭ, Mg, Ca, Ti, Al, Fe, Co, Ni, Си. Легко образуются при взаимод. интерметаллидов
даже с техн. Н2 (содержащим до 1-2% примесей О2 и
водяного пара) при 25-200°С и давлениях Н2 0,1-1 МПа; скорость
поглощения Н2 очень велика. Р-ции характеризуются малыми тепловыми
эффектами (20-30 кДж на 1 моль Н2, для индивидуальных металлов-100-120
кДж) и не приводят к значит. изменениям в структуре исходной металлич.
матрицы; в большинстве случаев происходит лишь увеличение ее объема на
10-30%. Для Г. этого типа характерна высокая подвижность водорода и большая
хим. активность (о св-вах см. также табл. 3).
При 200-500 °С и давлениях Н2 104-105
Па происходит гидрогенолиз интерметаллидов: мнх + м'ну
<- мм'n + н2 -> мнх + пМ'
Данная р-ция характерна для соед., образованных РЗЭ и Mg, а также РЗЭ
и Fe, Ni или Со. Так, гидрид РЗЭ, образующийся при гидрогенолизе интерметаллида,
содержащего Mg, катализирует как гидрирование Mg, так и дегидрирование
MgH2 при 150-180°С: МН2 + nMg + (n + 0,5) Н2 МН3 + nMgH2
МН3 + nMgH2
Благодаря высокому содержанию Н2, возможности значит. смещения
равновесия в ту или др. сторону посредством небольших изменений т-ры и
давления Н2, способности поглощать Н2 при низких
т-рах и устойчивости к действию О2 и влаги воздуха, Г. интерметаллич.
соединений м.б. использованы как хим. аккумуляторы слабосвязанного водорода.
Перспективно их применение как источников топлива для автономных энергосистем,
напр. автомобильного транспорта (см. Водородная энергетика), а также
для получения высокодисперсных металлич. порошков и катализаторов гетерог.
гидрирования.
Табл. 3.-СВОЙСТВА ГИДРИДОВ ИНТЕРМЕТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ

===
Исп. литература для статьи «ГИДРИДЫ»: Гидриды металлов, пер. с англ., М., 1973; Девятых ГГ., Зорин А.
Д., Летучие неорганические гидриды особой чистоты, М., 1974; Антонова А.
М., Морозова Р. А., Препаративная химия гидридов. К., 1976; Водород в металлах,
пер. с англ., т. 2, М., 1981. К.Н. Семененко.
Страница «ГИДРИДЫ» подготовлена по материалам химической энциклопедии.
|

