|
ГИДРОКСИЛАМИН NH2OH; мол. м. 33,0298; бесцв.
кристаллы. Конфигурация молекулы:
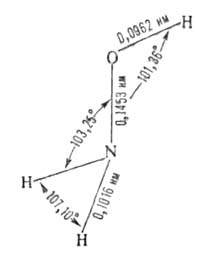
Кристаллич. решетка ромбическая; т. пл. 32°С; плотн. 1,335 г/см3
(10 °С);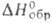 — 115,1 кДж/моль,
— 115,1 кДж/моль,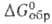 — 17,4 кДж/моль,
— 17,4 кДж/моль,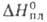 16,5 кДж/моль,
16,5 кДж/моль,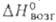 64,2 кДж/моль; для газа: С°p 46,67 Дж/(моль*К); S°298
236,07 Дж/(моль*К); давление пара при 32°С 705 Па (в парах мономерен);
64,2 кДж/моль; для газа: С°p 46,67 Дж/(моль*К); S°298
236,07 Дж/(моль*К); давление пара при 32°С 705 Па (в парах мономерен);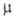 1,97-10-30 Кл*м.
1,97-10-30 Кл*м.
Г. очень гигроскопичен и термически нестабилен: медленно распадается
выше т-ры плавления, при быстром нагревании до 100°С иногда происходит
взрыв; осн. продукты распада-NН3, N2 и Н2О.
Расплав Г. легко переохлаждается и хорошо растворяет многие в-ва, напр.
NH3, KI, KCN, NaNO3, NaCl, NaOH. Г. смешивается с
водой, этанолом и метанолом в любых соотношениях, но не раств. в эфире
и бензоле. В водном р-ре диссоциирует по кислотному (рКа
14,02) и основному (рКа 5,97) типу:
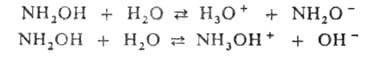
В кислом водном р-ре Г. устойчив; однако ионы переходных металлов катализируют
его распад, поэтому к р-ру добавляют связывающие их в-ва, напр. комплексоны,
SnO2*xH2O или станнаты.
В водном р-ре, как и в своб. состоянии, Г. может реагировать и как окислитель,
и как восстановитель. Он восстанавливает, напр., Fe(III) до Fe(II), Сu(И)
до Cu(I), Pu(IV) до Рu(Ш). Сильные восстановители (HI, H2S,
SnCl2, цинковая пыль и др.) восстанавливают его до NH3.
Кислород воздуха медленно окисляет Г. в щелочном (рН 12-13) р-ре с образованием
NO2- и Н2О2. Жидкий Г. с активными
окислителями (КМnО4, К2Сr2О7,
ВаО2, С12 и др.) реагирует с воспламенением, более
спокойно-с Вr2, К2СrО4, хлоратами, AgNO3
и др. С HNO2 в водном р-ре Г. при комнатной т-ре дает N2O
и Н2О. Р-ция с разб. HNO, автокаталитическая с промежут. образованием
HNO2. С газообразным NO в щелочном растворе Г. реагирует по
ур-нию: 2NH2OH + 2NO -> N2O + N, + ЗН2O
Хотя кислотная ф-ция у Г. выражена слабо, известно неск. его малостабильных
солей, напр. NaH2NO, Ca(H2NO)2, и ряд
более устойчивых комплексных соед., напр. [UO2(H2NO)2]*3H2O.
Благодаря наличию неподеленных электронных пар на атомах азота и кислорода
Г. легко образует прочные комплексы, напр. [Pt(NH2OH)4]Cl2,
[Ni(NH2OH)n]Cl2, в к-рых молекула Г. связана
с атомом металла через атом азота. Связь через атом кислорода осуществляется
в кристаллич. комплексах [LiNH2OH)3]ClO4
(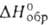 - 799,1 кДж/моль),
[Mg(NH2OH)6](C1O4)2 ( - 799,1 кДж/моль),
[Mg(NH2OH)6](C1O4)2 (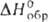 - 1457,7 кДж/моль), [Ca(NH2OH)3](ClO4),
(
- 1457,7 кДж/моль), [Ca(NH2OH)3](ClO4),
(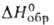 - 1156,4
кДж/моль) и др. Они устойчивы до 100 °C и менее гигроскопичны, чем соответствующие
простые соли М (С1О4)n и свободный Г. Реализуемая
в этих комплексах изомерная структура ONH3 на 126 кДж/моль энергетически
менее выгодна, чем структура Г. в своб. состоянии. - 1156,4
кДж/моль) и др. Они устойчивы до 100 °C и менее гигроскопичны, чем соответствующие
простые соли М (С1О4)n и свободный Г. Реализуемая
в этих комплексах изомерная структура ONH3 на 126 кДж/моль энергетически
менее выгодна, чем структура Г. в своб. состоянии.
С сильными к-тами Г. образует соли, содержащие катион гидроксиламмония
NH3OH. Наиб. важны хлорид NH3OHC1 (т. пл. 1524:,
плотн. 1,67 г/см3), сульфат (NH3OH)2SO4
(т. пл. 172°С) и перхлорат NН3ОНСlO4 (т. пл. 89 °С,
плотн. 2,07 г/см3,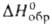 - 281,6 кДж/моль). Все три соли-бесцв. кристаллы с моноклинной решеткой;
хорошо раств. в воде, хлорид и перхлорат-также в спиртах и ацетоне. Хлорид
и сульфат начинают медленно разлагаться ниже т-р плавления, перхлорат -
выше 100°С.
- 281,6 кДж/моль). Все три соли-бесцв. кристаллы с моноклинной решеткой;
хорошо раств. в воде, хлорид и перхлорат-также в спиртах и ацетоне. Хлорид
и сульфат начинают медленно разлагаться ниже т-р плавления, перхлорат -
выше 100°С.
Атомы водорода в молекуле Г. могут быть замещены на разл. неорг. и орг.
остатки. При замещении на группу SO3K образуются гидроксиламинсульфонаты
- HONHSO3K, (KSO3)2NOH и KO3SON(SO3K)2.
К этой группе производных Г. относятся гидроксиламин-О-сульфокислота H2NOSO3H,
метилсульфонилгидроксиламин CH3SO2N(H)OH и N-амидосульфонилгидроксиламин
H2NSO2N (Н)ОН, к-рые м. б. использованы для получения
N2O. При нитрозировании Г. по атому N образуются азотноватистая
к-та H2N2O2 и ее соли - гипонитриты, а
при нитровании-соли азотноватой к-ты H2N2O3
(гипонитраты). С альдегидами и кетонами Г. и его соли дают соотв. альдоксимы
и кетоксимы. См. также Гидроксиламина производные органические.
В лаборатории Г. можно синтезировать разложением в вакууме его солей,
напр. (NH3OH)3PO4 или [Mg(NH2OH)6]ClO4.
Спиртовый р-р Г. получают действием C2H5ONa на NH3OHC1.
В пром-сти соли Г. получают восстановлением NO водородом в присут. Pt,
нанесенной на графит, в среде разб, H2SO4 при 40
°С или гидрированием HNO3 в присут. Pd в разб. Н3РО4.
Г. и его соли применяют для получения оксимов (напр., циклогексаноноксима),
гидроксамовых к-т. Г.-реагент для титриметрич. определения карбонильных
соединений. Сульфат Г.-компонент проявителя цветной фото- и кинопленки.
Перхлорат Г.-окислитель твердых ракетных топлив. Г. и его соли токсичны;
при попадании на кожу вызывают экземы и нагноения, при попадании в кровь
переводят гемоглобин в метгемоглобин и действуют на нервные центры. Для
NH3OHC1 ПДК в воде водоемов 5 мг/л.
===
Исп. литература для статьи «ГИДРОКСИЛАМИН»: Брикун И.К., Козловский М.Т., Никитина Л,В., Гидразин и
гидроксиламин и их применение в аналитической химии, А.-Д., 1967; Харитонов
Ю. Я., Сару ханов М. А., Химия комплексов металлов с гидроксиламином, М.,
1977. В. Я. Росоловскип.
Страница «ГИДРОКСИЛАМИН» подготовлена по материалам химической энциклопедии.
|

