|
ГЛИКОЛИ (алкандиолы), двухатомные спирты жирного ряда общей ф-лы
СnН2n(ОН)2. Группы ОН в молекулах могут
находиться у одного атома С (геминальные Г.), у соседних атомов (вицинальные)
и т.д. Названия Г. производят от названий соответствующих алканов или ал-кенов
и соотв. суффиксов "диол" или "гликоль", напр. НОСН2СН2ОН-1,2-этандиол
или этиленгликоль, НОСН2СН2СН2ОН-1,3-пропандиол
или 1,3-пропиленгликоль (триметиленгликоль).
Наиб, практич. значение имеют этиленгликоль, пропиленгликоли, бутиленгликоли
и нек-рые их производные, содержащие одну или более простых эфирных
групп в молекуле (т.н. полигликоли, напр. диэтиленгликолъ), высокомолекулярные
полиэтиленгликоли (см. Полиэтиленоксид).
Низшие Г.-бесцв. прозрачные вязкие жидкости (см. табл.) без запаха,
имеют сладковатый вкус, гигроскопичны. Наличие в молекуле двух групп ОН
обусловливает более высокие плотность, вязкость и т-ру кипения Г., чем
соответствующих одноатомных спиртов. Геминальные Г. нестойки, напр. метиленгликоль
существует только в водных р-рах.
СВОЙСТВА ПИКОЛЕЙ
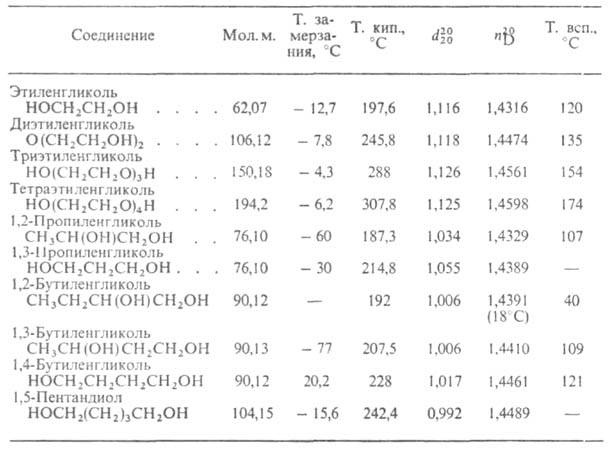
Низшие Г. (С2-С7) смешиваются с водой, спиртами,
альдегидами, кетонами, к-тами, аминами во всех соотношениях. Г., особенно
полигликоли, хорошо растворяют синтетич. смолы, лаки, краски, эфирные масла,
каучуки. Ароматич. углеводороды растворяются в Г. ограниченно, предельные
алифатич. углеводороды не растворяются. Благодаря водородным связям Г.
образуют ассоциаты с водой (гидраты), аминами и др. При образовании гидратов
значительно понижается т-ра замерзания водных р-ров Г. На этом св-ве основано
применение их как антифризов.
Г. обладают всеми хим. св-вами, характерными для спиртов. Гидроксильные
группы Г. реагируют независимо друг от друга или одновременно (поэтому
иногда образуются соответствующие смеси продуктов). Со щелочными металлами
и их гидроксидами Г. образуют гликоляты (напр., NaOCH2CH2ONa),
с одноосновными карбоновыми к-тами, их ангидридами или хлорангидридами
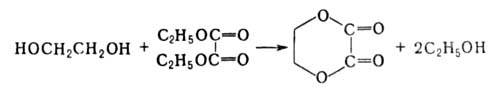
- сложные моно- и диэфиры, с двухосновными к-тами и их производными-линейные
сложные полиэфиры типа [—ORO—(O)CR'C(O)—]n, с низкомол. двухосновными
к-тами или их эфирами-циклич. соединения, напр.:
При действии галогеноводородов Г. легко превращаются в галогенгидрины,
напр. при нагр. с НС1 1,2-пропиленгликоля образуется смесь С1СН2СН(ОН)СН3
и НОСН2СН(С1)СН3; однако вторая группа ОН замещается
на галоген труднее (лучше - действием РС15 или SOC12).
С альдегидами и кетонами (кат.-FеС13, Н3РО4)
Г. дают циклич. ацетали (1,2-Г.-1,3-диоксоланы, 1,3-Г.-1,3-диоксаны), напр.:
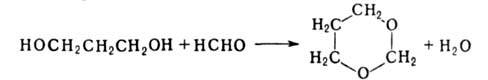
Под действием щелочных катализаторов Г. реагируют с ацетиленом с образованием
виниловых и дивиниловых эфиров: напр.:
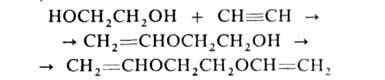
с акрилонитрилом - моно- или бис-цианэтиловых эфиров, напр.:
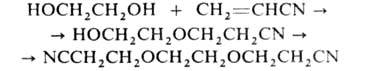
с эпоксидами при 140-180 °С - ди-, три- и полигликолей, напр.:
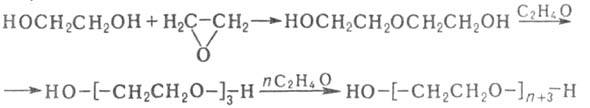
Характер продуктов, образующихся при дегидратации Г., определяется взаимным
расположением групп ОН в молекуле и условиями р-ции. Так, под действием
ZnCl2, разб. H2SO4 при слабом нагревании
вициналопые Г. превращаются в альдегиды или кетоны, напр.: НОСН2СН2ОН
-> СН3СНО, 1,2-пропиленгликоль в присут. Н3РО4
на цеолите при 250°С- в осн. в СН3СН2СНО, пипакопы
в результате пинаколиновой перегруппировки-в пинаколины. Г. (кроме
вицинальных) превращаются в ненасыщ. спирты или диены, напр.:
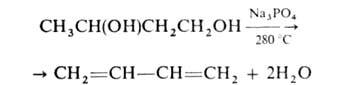
Кислородом Г. окисляются до пероксидов, формальдегида, ацетона, муравьиной
к-ты, сложных эфиров и др.; действием К2Сr2О7
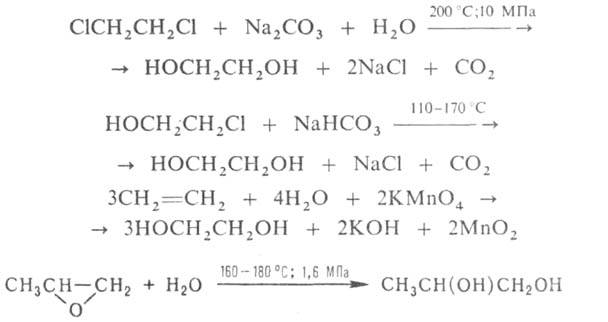
или КМnО4-до СО2 и Н2О. Осн. методы синтеза
Г.:
Г.-р-рители, пластификаторы. Они применяются также для приготовления
антифризов и гидравлич. жидкостей (этилен- и пропиленгликоли), для синтеза
эфиров Г., полиэфирных смол, полиуретанов (1,2-пропиленгликоль, 1,4-бутиленгликоль),
увлажнения разл. продуктов, напр. табака, казеина, желатины.
Токсичность Г. убывает с увеличением мол. массы.
===
Исп. литература для статьи «ГЛИКОЛИ»: ДыментО.Н., Казанский К.С., Мирошников А. М., Гликоли и
другие производные окисей этилена и пропилена, М., 1976; Kirk-Othmer encyclopedia,
2 ed., v. 10, N.Y., 1966. Б. Б. Чесноков.
Страница «ГЛИКОЛИ» подготовлена по материалам химической энциклопедии.
|

