|
ГЛУТАМАТДЕГИДРОГЕНАЗА, фермент, катализирующий взаимопревращение
L-глутаминовой и 2-оксоглутаровой к-т:
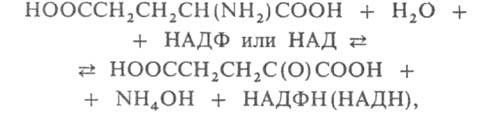
где НАДФ (НАД) и НАДФН (НАДН) соотв. окисленная и восстановленная форма
кофермента никотинамидаденин-динуклеотидфосфата (никотинамидадениндинуклеотида)
- акцепторы и переносчики электронов и водорода на промежут. стадиях. Относится
к классу оксидоредуктаз.
Различают Г. специфичные к НАД, НАД и НАДФ или только к НАДФ. Фермент
имеет мол. м. 210-480 тыс. и обычно состоит из 4 или 6 одинаковых субъединиц.
В активном центре содержатся остатки лизина, тирозина и ци-стеина. Третичная
структура характеризуется наличием доменов с мол. м. 20 тыс. Известна первичная
структура нескольких Г. Оптим. каталитич. активность при аминировании в
области рН 7,5-8,5, при дезаминировании 8,5-9,5.
Г. содержится в животных, растениях и микроорганизмах. В бактериях и
синезеленых водорослях представлена одной формой, в др. организмах - неск.
изоферментами. Долгое время Г. рассматривали как осн. фермент первичной
ассимиляции NH3. Низкое сродство Г. к NH4+,
а также открытие глутаматсинтазы, обнаруженной во всех, кроме животных,
организмах, свидетельствуют, что роль Г. в ассимиляции NH3 незначительна.
===
Исп. литература для статьи «ГЛУТАМАТДЕГИДРОГЕНАЗА»: Шатилов В. Р., "Успехи биологической химии", 1982, т. 23,
с. 185-209; Fisher H.F., "Advances in Enzymology", 1973, v. 39, p. 369-417;
Eisenberg H., Josephs R., Reisler E., "Advances in Protein Chemistry",
1976, v. 30, p. 101-81. А.В.Пушкин.
Страница «ГЛУТАМАТДЕГИДРОГЕНАЗА» подготовлена по материалам химической энциклопедии.
|

