|
ДАВЛЕНИЕ, физ. величина, характеризующая интенсивность нормальных
(перпендикулярных к пов-сти) сил, с к-рыми одно тело действует на пов-сть
другого. Давление - один из основных параметров состояния термодинамич. системы,
входящий в уравнения состояния (вместе с т-рой и уд. объемом). При
равномерном распределении сил вдоль пов-сти Д. р определяется как
сила F, действующая по нормали к пов-сти на площадь S: р = F/S.
Если распределение сил по пов-сти неравномерно, рассматривают Д. в
данной точке:
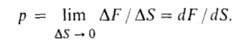
Единица Д. в системе СИ-паскаль (Па); 1 Па = 1 Н/м2. В кач-ве
единиц Д. используют также бар, атмосферу и кгс/см2; 0,1 МПа
=1 бар = 1,0197 кгс/см2 = 0,98692 атм. Нормальное Д.-101325
Па.
При сжатии газов и жидкостей прилагаемая нагрузка распределяется в в-ве
изотропно, т.е. давелние по всем направлениям одинаково (гидростатич. Д.). При
сжатии твердых тел возникающие в объеме тела напряжения обычно распределяются
неравномерно. В этом случае под Д. в данной точке понимают среднее арифметическое
нормальных напряжений, действующих в трех взаимно перпендикулярных направлениях.
Д. условно делят на низкие, умеренные, высокие и сверхвысокие. Диапазон
Д., наз. высокими, различен в разных областях науки и техники. В химии
обычно высокими считают давление свыше 100 МПа. Различают статические Д., существующие
при длительных режимах сжатия, и динамические, действующие кратковременно,
напр. при взрыве. Диапазон высоких Д., встречающихся в природе, весьма
широк. Статич. Д., обусловленное гравитационным полем Земли, достигает
в глубинах океана 100 МПа, в центре Земли-360 ГПа. На звездах (белые карлики)
статическое давление составляет 1010-1012 ГПа. В пром-сти освоены
статич. Д. 6-8 ГПа, в лаб. условиях достигнуто Д. 170 ГПа. Сжатие в-ва
в статическом режиме может осуществляться при высоких температурах (~ 3000
К), а также при дополнительном наложении напряжений сдвига, вызывающих
пластическую деформацию. Динамич. Д., при к-рых выполняются физ.-хим. исследования
конденсированных систем, достигают 500 ГПа.
Д. до 1 ГПа обычно измеряют манометрами, свыше 1 ГПа-датчиками
из сплавов металлов (напр., манганина), электрическое сопротивление которых
зависит от Д.
Сведения о влиянии высоких Д. на физ.-хим. св-ва в-в появились в 19
в. Систематич. изучение поведения в-в при высоких Д. было начато в 20-х
гг. 20 в. Основополагающие результаты в этой области были получены П. Бриджменом.
В СССР аналогичные исследования были начаты в 30-е гг. Важную роль в развитии
исследований физ. и хим. процессов сыграли работы Л. Ф. Верещагина с сотр.
В данной статье рассматривается действие на в-во статич. Д.; о физ.-хим.
исследованиях при динамич. давление см. в ст. Взрыв, Ударных труб метод.
Влияние Д. на физ. св-ва в-в. Непосредственным результатом действия
давления является сжатие в-ва, т. е. изменение его объема вследствие изменения
межатомных (межмолекулярных) расстояний. Способность в-ва изменять свой
объем под действием Д. характеризуется сжимаемостью. С увеличением
Д. плотность газов растет и при Д. порядка сотен МПа приближается к плотности
жидкостей. При 1 ГПа плотность большинства жидкостей возрастает на 20-30%
по сравнению с плотностью при нормальном давлении Для многих металлов при 10
ГПа плотность возрастает на 6-15%, для др. твердых тел-на 15-25%. Изменение
объема жидкости или сильно сжатого газа в интервале Д. от нек-рого начального
р0 до значения р м. б. описано ур-нием Тейта:
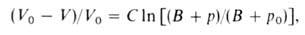
где V0 и V-объем в-ва при Д. р0 и р
соотв., С и В-эмпирич. постоянные.
Вязкость жидкостей увеличивается с Д. (см. рис. 1). Ди-электрич. проницаемость в-ва обычно возрастает с Д., что обусловлено в основном изменением плотности.
Для многих в-в зависимость
в-ва обычно возрастает с Д., что обусловлено в основном изменением плотности.
Для многих в-в зависимость от Д. удовлетворительно описывается ур-нием:
от Д. удовлетворительно описывается ур-нием:
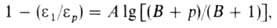
где и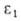 -диэлектрич.
проницаемость при давлении р и 1 -диэлектрич.
проницаемость при давлении р и 1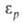 атм, А и В-эмпирич. постоянные. Т-ры плавления tпл подавляющего
большинства в-в повышаются с Д. (см. рис. 2). Исключения-вода, Bi, Ga,
Ge и нек-рые другие в-ва, плотность к-рых в твердой фазе ниже, чем в жидкой.
Однако и у этих в-в по достижении Д. перехода твердой фазы с низкой плотностью
в др. кристаллич. модификацию с плотностью большей, чем у жидкости, начинается
рост tпл с Д. Для описания зависимости tпл от Д.
широко используют ур-ние Саймона:
атм, А и В-эмпирич. постоянные. Т-ры плавления tпл подавляющего
большинства в-в повышаются с Д. (см. рис. 2). Исключения-вода, Bi, Ga,
Ge и нек-рые другие в-ва, плотность к-рых в твердой фазе ниже, чем в жидкой.
Однако и у этих в-в по достижении Д. перехода твердой фазы с низкой плотностью
в др. кристаллич. модификацию с плотностью большей, чем у жидкости, начинается
рост tпл с Д. Для описания зависимости tпл от Д.
широко используют ур-ние Саймона:
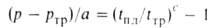
где ртр и tтр-давление и т-ра тройной точки в-ва,
а и с-эмпирич. постоянные.
Под Д. твердые тела нередко претерпевают полиморфные переходы. Так,
при 20 °С и 5,5 ГПа Ва с кубич. объемноцентрированной решеткой переходит
в гексагональную модификацию типа Mg. Другие примеры-фазовые переходы Т1
при 3,7 ГПа, КС1 при 2 ГПа, AgCl при 9 ГПа, нафталина при 2,5 ГПа. При
т-рах > 1300 К и давлениях >4 ГПа наблюдается переход графит-алмаз; тройная
точка алмаз-графит-расплав соответствует 3000 К и 12,4 ГПа. При Д. свыше
100 ГПа предполагается существование фазового перехода твердого водорода
с образованием структуры, построенной из атомов и обладающей металлич.
св-ва-ми. У орг. в-в при изменении Д. обнаруживается обычно больше полиморфных
переходов, чем у неорганических.
Растворимость в жидкостях газов и их смесей (при условии, что они близки
по своему поведению к идеальным газам) с ростом Д. увеличивается (см. Генри
закон, Дальтона законы). Влияние Д. на р-римость тел зависит от того,
как изменяется с Д. молярный объем в-ва и его парциальный молярный объем
в р-ре. Если при нек-ром Д. молярный объем в-ва становится меньше его парциального
молярного объема, р-римость в-ва, в соответствии с Ле Шателье Брауна
принципом, с ростом Д. снижается. Такая закономерность характерна для
реальных газов и твердых тел в случае неполярных р-рителей. Напр., при
500 МПа р-римость гексахлорэтана и SnI4 в CS2 уменьшается
по сравнению сих р-римостью при 0,1 МПа в 15 и в 7,5 раза соотв. Для газов
с ограниченной р-римостью в жидкости характерно наличие максимума на кривой
зависимости р-римости от Д. Если в-во при растворении диссоциирует на ионы,
то при оценке влияния Д. дополнительно следует учитывать изменение молярного
объема в результате сольватации ионов молекулами р-рителя.
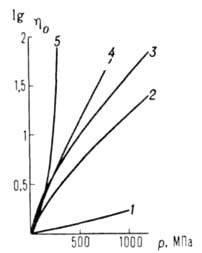
Рис. I. Зависимость относительной вязкости (
( -вязкость
при 1 атм) от давления р для различных жидкостей. 1 - вода, 2 -этанол,
3 -пентан, 4 - глицерин, 5 - эвгенол -вязкость
при 1 атм) от давления р для различных жидкостей. 1 - вода, 2 -этанол,
3 -пентан, 4 - глицерин, 5 - эвгенол
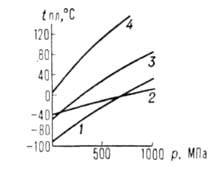
Рис. 2. Зависимость т-ры плавления tпл от давления р для
различных в-в. 1 ацетон, 2 ртуть, 3 хлорбензол, 4-бензол.
При высоких Д. возможно расслоение гомогенной газовой смеси на две фазы
при т-рах, превышающих критич. т-ры компонентов смеси. Этот эффект был
экспериментально обнаружен И. Р. Кричевскимссотр. в 1941-43 (см. Критическое
состояние).
Влияние Д. на хим. р-ции. При сжатии газовых реакц. смесей в
области Д., ограниченных десятками МПа, наблюдается увеличение скорости
р-ций и смещение хим. равновесия. Это объясняется гл. обр. изменением концентраций
реагирующих в-в (см. Действующих масс закон). Для в-в в конденсированной
фазе или для газов при Д. выше 200-300 МПа повышение концентрации реагентов
с ростом Д. невелико, тем не менее многие процессы чувствительны к Д. Так,
Д. существенно влияет на равновесие электролитич. диссоциации к-т и оснований,
изменяет концентрацию комплексов с переносом заряда, влияет на равновесие
кето-енольной таутомерии, на конформац. равновесие, смещает равновесие
мономер-полимер и т.д. Под Д. удается осуществить полимеризацию в-в, для
к-рых равновесие мономер-полимер при атмосферном Д. смещено в сторону мономера.
Для идеальных газовых смесей зависимость константы равновесия КХ(Т,
р)(концентрации реагирующих в-в выражены в молярных долях х) от Д.
при постоянной т-ре Т выражается ур-нием:
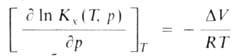
где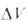 -изменение
объема системы вследствие хим. р-ции, R-газовая постоянная. Влияние
Д. на КХ(Т, р)определяется знаком -изменение
объема системы вследствие хим. р-ции, R-газовая постоянная. Влияние
Д. на КХ(Т, р)определяется знаком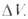 При При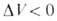 Д. смещает равновесие в сторону продуктов р-ции. Для р-ций в конденсированной
фазе влияние Д. на КХ(Т, р)описывается ур-нием:
Д. смещает равновесие в сторону продуктов р-ции. Для р-ций в конденсированной
фазе влияние Д. на КХ(Т, р)описывается ур-нием:
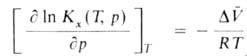
где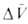 -изменение
парциального молярного объема в результате р-ции, равное разности между
парциальными моляоны-ми объемами исходных в-в -изменение
парциального молярного объема в результате р-ции, равное разности между
парциальными моляоны-ми объемами исходных в-в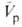 и
продуктов и
продуктов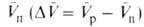 Величина
Величина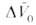 , получаемая
экстраполяцией опытных данных к р = 1 атм, наз. объемным эффектом
р-ции. При , получаемая
экстраполяцией опытных данных к р = 1 атм, наз. объемным эффектом
р-ции. При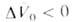 Д. смещает равновесие в сторону продуктов реакции. Значения
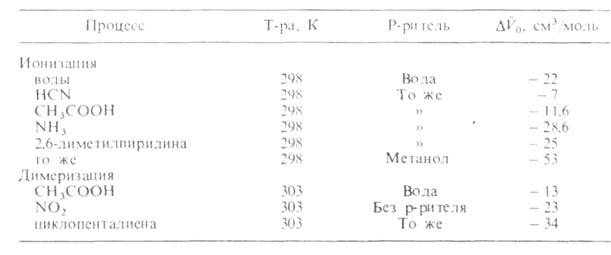
Д. смещает равновесие в сторону продуктов реакции. Значения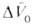 для нек-рых р-ций приведены в табл. 1.
для нек-рых р-ций приведены в табл. 1.
Табл. 1 -ОБЪЕМНЫЕ ЭФФЕКТЫ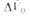 НЕК-РЫХ Р-ЦИЙ
НЕК-РЫХ Р-ЦИЙ
Скорости р-ций по-разному изменяются с давлением (см. рис. 3). Бимолекулярные
р-ции обычно ускоряются с Д., мономолекулярные-замедляются. Так, скорость
диенового синтеза при повышении Д. до 1000 МПа может возрастать в тысячи
раз, а р-ции распада обычно затормаживаются. Согласно активированного
комплекса теории, зависимость от Д. константы скорости элементарной
р-ции к (Т, р)при постоянной т-ре определяется изменением молярного
объема реагентов при образовании активированного комплекса
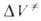 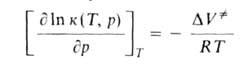
(концентрации реагентов выражены моляльностями). Если полярность активированного
комплекса отличается от полярности молекул реагентов, то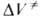 складывается из двух объемных эффектов:
складывается из двух объемных эффектов: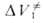 ,
обусловленного изменением молярного объема самих реагентов, и ,
обусловленного изменением молярного объема самих реагентов, и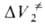 ,
обусловленного перестройкой сольватных оболочек реагирующих частиц в момент
образования активированного комплекса. ,
обусловленного перестройкой сольватных оболочек реагирующих частиц в момент
образования активированного комплекса.
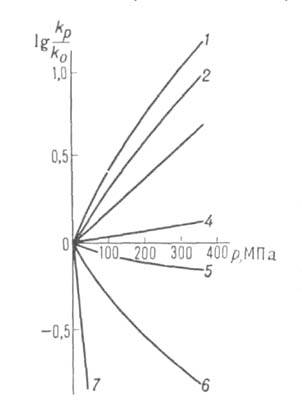
Рис. 3. Зависимость константы скорости kp от давления р для различных
р-ций (k0-константа скорости р-ции при 1 агм). 1-ди-меризация
циклопентадиена (293 К); 2-полимеризация метилметакрилата (313 К); 3-нитрование
толуола (273 К); 4-гидролиз этиленимина (338 К); 5-распад 2,2-азо-бис-изобутиронитрила
(313 К); 6-гид-ролиз Co(NH3)5SO4+
+ ОН- (288 К).
Величина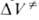 изменяется с Д., поэтому график зависимости In к от р, как правило, не
является прямой линией. Для описания зависимости In к от р нередко
используют степенные ф-ции, напр.:
изменяется с Д., поэтому график зависимости In к от р, как правило, не
является прямой линией. Для описания зависимости In к от р нередко
используют степенные ф-ции, напр.:
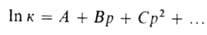
где А, В, С-эмпирич. постоянные.
Для диенового синтеза зависимость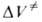 от р удовлетворительно описывается ур-нием Тейта при подстановке
в это ур-ние вместо V и V0 значений
от р удовлетворительно описывается ур-нием Тейта при подстановке
в это ур-ние вместо V и V0 значений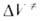 и
и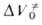 соотв.
Величина соотв.
Величина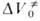 , равная
, равная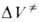 при
р = атм, имеет важное теоретич. значение, поскольку в ряде случаев
она позволяет СУДИТЬ о строении активированного комплекса. Значения при
р = атм, имеет важное теоретич. значение, поскольку в ряде случаев
она позволяет СУДИТЬ о строении активированного комплекса. Значения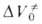 изменяются в широких пределах в зависимости от типа р-ции (табл. 2). В
случае сложной р-ции связь
изменяются в широких пределах в зависимости от типа р-ции (табл. 2). В
случае сложной р-ции связь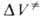 для р-ции в целом со значениями
для р-ции в целом со значениями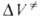 для элементарных стадий зависит от конкретного механизма процесса. Напр.,
для радикальной полимеризации
для элементарных стадий зависит от конкретного механизма процесса. Напр.,
для радикальной полимеризации
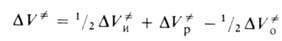 > >
где индексы "и", "р" и "о" относятся соотв. к инициированию, росту и
обрыву полимерных цепей.
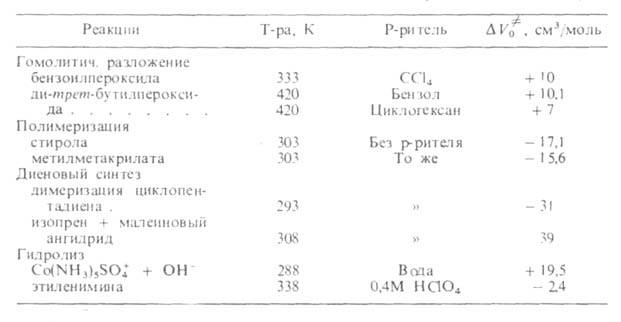
Табл. 2 ОБЪЕМНЫЕ ЭФФЕКТЫ АКТИВАЦИИ НЕК-РЫХ Р-ЦИЙ
АКТИВАЦИИ НЕК-РЫХ Р-ЦИЙ
Изменение скорости хим. процессов м. б. обусловлено также влиянием Д.
на физ. св-ва среды. Так, вследствие возрастания вязкости с повышением
Д. р-ции могут перейти из кинетич. области протекания в диффузионную, когда
скорость р-ции контролируется диффузией реагирующих частиц (см. Макрокинетика).
Изменяя е среды, Д. влияет на скорость ионных р-ций. При этом объемные
эффекты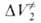 , вызванные
сольватацией ионов или заряженных групп молекул, учитываются с помощью
ур-ния Друде-Нернста-Борна: , вызванные
сольватацией ионов или заряженных групп молекул, учитываются с помощью
ур-ния Друде-Нернста-Борна:
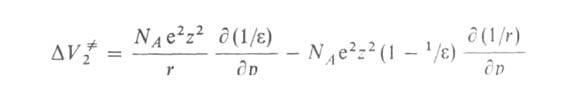
где NA -постоянная Авогадро, r и z-радиус и
зарядовое число иона соотв.
Хим. взаимод. в твердой фазе обычно замедляется с ростом Д. Для интенсификации
твердофазных р-ций (синтез минералов, полимеризация и др.) их проводят
при высоких т-рах.
Взаимодействие твердых в-в под Д. резко усиливается, если реагенты подвергаются
пластич. деформации сдвига. В этих условиях реализуются многие твердофазные
хим. процессы: полимеризация, нуклеоф. присоединение аммиака, воды, карбоксильной
группы к связи С=С, синтез амидов и пептидов, разложение пероксидов, карбонилов
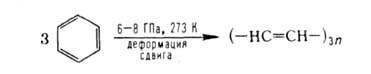
и оксидов металлов, неорганич. солей, р-ции этерификации и др. Ароматич.
соед. при деформации под Д. нередко претерпевают превращения, сопровождающиеся
разрывом цикла:
Скорости хим. р-ций при одновременном действии высоких Д. и деформаций
сдвига очень велики и могут превосходить скорости соответствующих жидкофазных
процессов при тех же давлениях и т-рах в миллионы и более раз. Реакционная способность
твердых в-в (константы скорости, выходы продуктов) в значит. степени зависят
от физ. св-в среды (пластичности, предельного напряжения сдвига, кристаллич.
структуры). Как правило, реакционная способность в-ва возрастает, если
его деформировать в смеси с пластичным в-вом, обладающим напряжением сдвига
большим, чем у чистого реагента. В условиях деформации выход продуктов
р-ции является ф-цией деформации сдвига (при постоянных давлении и т-ре) и в
широких пределах не зависит от времени деформирования реакционной смеси
(рис. 4). Время деформирования м. б. очень малым и исчисляться долями с.
Зависимость выхода продуктов от деформации сдвига удается описать в ряде
случаев (напр., при полимеризации акриламида) методами формальной кинетики
при замене в дифференц. ур-ниях времени на деформацию сдвига.
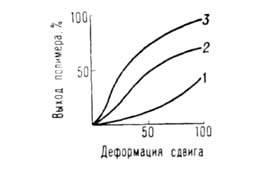
Рис. 4. Зависимость выхода полимера (в %) от деформации сдвига (полимеризация
при 2 ГПа) (293 К). 1-малеиновый ангидрид, 2-метакриламид, 3-акриламид.
Биохимии, эффекты высоких давлениях. При Д. в неск. сотен МПа происходит
денатурация белков, при этом меняются их антигенные св-ва, снижается активность
токсинов. Особенно чувствительны к Д. процессы образования связей белок-лиганд
и белок-белок. Так, для белков характерно значит. уменьшение скорости ассоциации
с повышением Д. ( положительны и могут исчисляться сотнями см3/моль). Денатурирующее
влияние Д. зависит от природы белка, т-ры и рН среды. Напр., овальбумин
необратимо коагулирует при 800 МПа, тогда как р-ры альбумина не претерпевают
изменений даже при 1,9 ГПа. Д. может препятствовать тепловой денатурации
белка и даже вызывать ренатурацию белка, денатурированного нагреванием.
Большинство ферментов инактивируется под действием Д. Напр., активность
пепсина снижается с повышением Д. и при 600 МПа исчезает. Однако в ряде
случаев давление стимулирует активность ферментов. Так, активность ксантиндегидрогеназы
с ростом давления возрастает и проходит через максимум: при 500 МПа ее реакционная
способность в 7-8 раз выше, а при 600 МПа лишь в 4 раза превышает активность
этого фермента при атмосферном Д. Выше 600 МПа наступает полная инактивация
ксантиндегидрогеназы. Р-ры молекул ДНК устойчивы к Д.: они не претерпевают
изменений даже при сжатии до 1,9 ГПа.
положительны и могут исчисляться сотнями см3/моль). Денатурирующее
влияние Д. зависит от природы белка, т-ры и рН среды. Напр., овальбумин
необратимо коагулирует при 800 МПа, тогда как р-ры альбумина не претерпевают
изменений даже при 1,9 ГПа. Д. может препятствовать тепловой денатурации
белка и даже вызывать ренатурацию белка, денатурированного нагреванием.
Большинство ферментов инактивируется под действием Д. Напр., активность
пепсина снижается с повышением Д. и при 600 МПа исчезает. Однако в ряде
случаев давление стимулирует активность ферментов. Так, активность ксантиндегидрогеназы
с ростом давления возрастает и проходит через максимум: при 500 МПа ее реакционная
способность в 7-8 раз выше, а при 600 МПа лишь в 4 раза превышает активность
этого фермента при атмосферном Д. Выше 600 МПа наступает полная инактивация
ксантиндегидрогеназы. Р-ры молекул ДНК устойчивы к Д.: они не претерпевают
изменений даже при сжатии до 1,9 ГПа.
Методы создания высоких Д. Статич. Д. до неск. сотен МПа в жидкостях
и газах создают насосами или компрессорами. С их помощью реакционная смесь
нагнетается в аппарат высокого Д., в к-ром компоненты смеси взаимод. при
заданных давлении и т-ре. В кач-ве аппаратов высокого Д. широко используют автоклавы
(рис. 5)-цилиндрич. сосуды емкостью от десятков см3 до неск.
м3, снабженные герметич. затвором. Автоклавы изготавливают,
как правило, из высококачественных сталей; внутренняя пов-сть аппарата
нередко футеруется химически стойкими материалами (фторопласты, эмаль).
Автоклавы могут снабжаться мешалками, оси к-рых выводятся через сальник.
Внутри автоклава может размещаться мешалка с ротором электромотора; при
этом электромагнитное поле статора, расположенного снаружи, взаимод. с
ротором через стенки автоклава, выполненные из немагнитного материала.
Д. в автоклаве либо создается компрессором, либо возникает в результате
разогрева выделяющимся при р-ции теплом или внешнего обогрева. Диапазон
Д. и т-р, создаваемых в автоклавах, ограничен обычно 100 МПа и 600 К.
Для создания Д., исчисляемых ГПа, служат устройства, использующие разл.
конструкционные принципы. В-во, помещенное в цилиндрич. сосуд, сжимается
при вдавливании штоков с помощью пресса (рис. 6а). Гидравлич. пресс и камера
высокого Д. могут быть объединены в одну конструкцию-мультипликатор (рис.
6б). Д. в рабочей камере мультипликатора рассчитывается по соотношению:
РВ = pH(SH/SB), где SH и SB-площади
поршней цилиндров низкого (рн) и высокого (РВ) Д. При использовании
высокопрочных сталей для цилиндра и сверхтвердых сплавов для штоков эта
конструкция позволяет работать при Д. до 4-5 ГПа. В аппаратуре типа наковален
(рис. 6в) в-во размещается между плоскостями двух усеченных конусов (наковален).
Для создания высокого Д. наковальни сжимают с помощью пресса. Большая прочность
аппаратуры достигается использованием двух конструкционных приемов: заменой
напряжений растяжения напряжением сжатия и массивной поддержкой нагруженной
центральной части наковален со стороны прилегающих ненагруженных частей.
Наковальни изготавливают обычно из твердых сплавов. Достоинства такой аппаратуры-простота
конструкции и возможность достижения давления в десятки ГПа, недостаток-малый
объем рабочего пространства.
Для физ.-хим. исследований при высоких Д. применяют установки с прозрачными
наковальнями из алмазов, обеспечивающие Д. до 200 ГПа и т-ры до 3000 К.
Такие установки компактны (располагаются на столике микроскопа). Нагрев
образца осуществляют лазерным лучом. Для измерения Д. внутрь аппарата помещают
кристалл рубина и следят за его спектром люминесценции, линия к-рого смещается
с увеличением Д. линейно до 30 ГПа. Помимо визуального наблюдения, эти
аппараты позволяют проводить исследования методами УФ, ИК, рентгеновской
и гамма-резонансной спектроскопии. Для достижения Д. в 100-200 ГПа при
т-рах до 2500 К используют установки, в к-рых совмещаются конструкционные
приемы аппаратов типа цилиндр-поршень и типа наковален (рис. 6г). Д. в
образце создается при вдавливании конич. пуансонов с помощью пресса. Достоинство
аппаратов-сравнительно большой объем рабочего пространства, недостаток-сложность
в изготовлении.
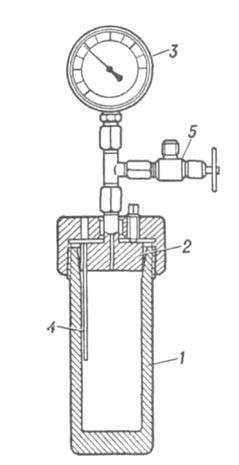
Рис. 5. Схема типового автоклава: 1 - корпус; 2-крышка; 3-манометр;
4-карман для термопары; 5-вентиль.
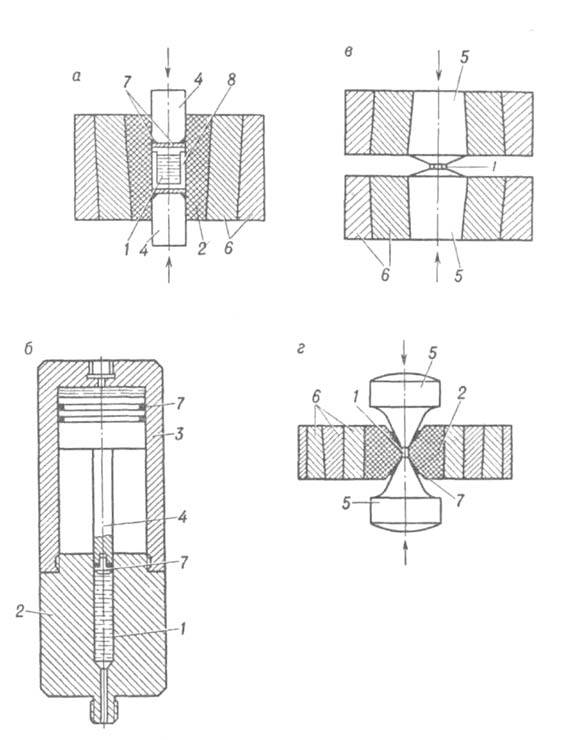
Рис. 6. Схема установок, применяемых для физ.-хим. исследований при
высоких давлениях: а-цилиндр со штоками; 6-мультипликатор; в-аппаратура
типа наковален; г-устройство с конич. пуансонами, 1-исследуемое в-во; 2-цилиндр
высокого давления; 3-цилиндр низкого давления; 4 -штоки; 5-пуансоны; 6-поддерживающие
кольца; 7-уплотнения; 8-ампула с в-вом.
Для экспериментов в условиях высоких Д. и деформаций сдвига используют
аппаратуру типа наковален. Между наковальнями располагают слой твердой
реакционной смеси, в к-ром создается Д. при сжатии наковален с помощью
пресса. Заданная деформация сдвига производится поворотом одной из наковален
на определенный угол. Время поворота наковален (а след., и хим. превращения)
обычно исчисляется с или долями с.
Статич. высокие Д. широко используют в хим. пром-сти. Среди особо важных
процессов-произ-во синтетич. алмазов (5-6 ГПа), синтез боразона (6-8 ГПа),
полимеризация этилена (120-320 МПа), гидротермальный синтез минералов (до
300 МПа), гидрогенизация угля (до 70 МПа), синтез метанола (30 МПа) и аммиака
(30 МПа), гидрокрекинг (5-20 МПа) и др. При лаб. исследованиях жидкофазных
хим. процессов высокие давления (500-1500 МПа) используют гл. обр. для сокращения
продолжительности хим. превращений. Особенно это важно, если скорость р-ции
при атмосферном давлении низка, а повышать ее путем нагрева реакционной смеси
нежелательно из-за возможности возникновения побочных р-ций или нестойкости
реагентов (продуктов) р-ции. При высоких давлениях проводят распространенные в
лаб. практике синтезы, если необходимо увеличить выход целевого продукта.
===
Исп. литература для статьи «ДАВЛЕНИЕ»: Гоникберг М. Г., Химическое равновесие и скорость реакций
при высоких давлениях, 3 изд., М., 1969; Циклис Д.С., Техника физико-химических
исследований при высоких и сверхвысоких давлениях, 4 изд., М., 1976; Проблемы
эксперимента в твердофазной и гидротермальной аппаратуре высокого давления,
под ред. И.П.Иванова и Ю.А. Литвина, М., 1982; Жаров А.А., "Успехи химии",
1984, т. 53, в. 2, с. 236-50; Современная техника и методы экспериментальной
минералогии, под .ред. В.А.Жарикова. И.П.Иванова и Ю.А. Литвина, М., 1985;
Isaacs N.S., Liquid phase high pressure chemistry, N. Y.-Brisban-Toronto,
1981; H ereman s K., "Ann.Rev.Biopbys", 198Z X"0 11, p. 1-21;
Matsumoto K, Sera A., Uchida Т., "Syptesis", 1985, № 1, p. 1-26; № 11,
p. 99. А. А. Жаров.
Страница «ДАВЛЕНИЕ» подготовлена по материалам химической энциклопедии.
|

