|
АЛЬДЕГИДО- И КЕТОКИСЛОТЫ (оксокарбоновые к-ты, оксокислоты),
соединения, содержащие карбоксильную и карбонильную (альдегидную или кетонную)
группы. В соответствии с взаимным расположением этих групп в молекуле различают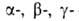 и т.д. оксокарбоновые к-ты. Эти к-ты сильнее соответствующих алканкарбоновых,
причем самые сильные-
и т.д. оксокарбоновые к-ты. Эти к-ты сильнее соответствующих алканкарбоновых,
причем самые сильные-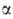 -оксокислоты.
А.- и к. вступают в р-ции, характерные для групп СООН и СО (см. Карбоновые
кислоты. Альдегиды, Кетоны). -оксокислоты.
А.- и к. вступают в р-ции, характерные для групп СООН и СО (см. Карбоновые
кислоты. Альдегиды, Кетоны).
Единственный представитель альдегидокислот — глиоксалевая (глиоксиловая) к-та НС(О)СООН — гигроскопичная
бесцв. вязкая жидкость. Получается окислением, напр. азотной к-той, этиленгликоля
или гликолевой к-ты, а также восстановлением щавелевой к-ты на ртутном
катоде. Альдегидная группа под влиянием соседней карбоксильной легко присоединяет
нуклеоф. реагенты, в частности с Н2О образуется прочный гидрат
(НО)2СНСООН (т. пл. 98°С; легко раств. в воде, трудно-в спирте
и эфире, не раств. в углеводородах). Превращается в щавелевую и гли-колевую
к-ты в результате диспропорционирования: 2НС(О)СООН -> НООССООН + НОСН2СООН.
Применяется в произ-ве душистых (в т.ч. ванилина) и лек. в-в, красителей,
для расщепления оксимов и гидразонов кето-нов.
альдегидокислот — глиоксалевая (глиоксиловая) к-та НС(О)СООН — гигроскопичная
бесцв. вязкая жидкость. Получается окислением, напр. азотной к-той, этиленгликоля
или гликолевой к-ты, а также восстановлением щавелевой к-ты на ртутном
катоде. Альдегидная группа под влиянием соседней карбоксильной легко присоединяет
нуклеоф. реагенты, в частности с Н2О образуется прочный гидрат
(НО)2СНСООН (т. пл. 98°С; легко раств. в воде, трудно-в спирте
и эфире, не раств. в углеводородах). Превращается в щавелевую и гли-колевую
к-ты в результате диспропорционирования: 2НС(О)СООН -> НООССООН + НОСН2СООН.
Применяется в произ-ве душистых (в т.ч. ванилина) и лек. в-в, красителей,
для расщепления оксимов и гидразонов кето-нов.
 Кетокислоты
получают окислением Кетокислоты
получают окислением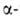 гидроксикислот.
Важнейшая из них-пировиноградная гидроксикислот.
Важнейшая из них-пировиноградная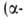 кетопропионовая)
СН3СОСООН-бесцв. жидкость с резким запахом; т. пл. 13,6°С, т.
кип. 165 СС (с разл.), 65°С/10 мм рт.ст.; d™ 1,27; раств.
в воде, эфире, спирте. М.б. получена перегонкой винной к-ты над KHSO4,
из ацетилхлорида или 2,2-дихлорпропионовой к-ты. Легко отщепляет СО2
или СО: кетопропионовая)
СН3СОСООН-бесцв. жидкость с резким запахом; т. пл. 13,6°С, т.
кип. 165 СС (с разл.), 65°С/10 мм рт.ст.; d™ 1,27; раств.
в воде, эфире, спирте. М.б. получена перегонкой винной к-ты над KHSO4,
из ацетилхлорида или 2,2-дихлорпропионовой к-ты. Легко отщепляет СО2
или СО:
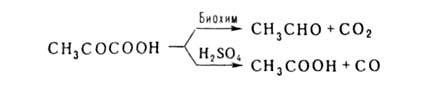
Окисляется Н2О2 в уксусную к-ту. Является важнейшим
промежут. продуктом, связывающим превращения углеводов, белков и липидов
(см., напр., Трикарбоновых кислот цикл). Применяется в произ-ве
лек. в-в, напр. цинхофена (атофана).
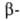 А.- и к.
неустойчивы и самопроизвольно декарбоксилируются. Специфич. метод синтеза А.- и к.
неустойчивы и самопроизвольно декарбоксилируются. Специфич. метод синтеза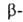 оксокислот
и их эфи-ров-конденсация сложных эфиров карбоновых к-т под действием Na
или его алкоголятов (конденсация Гейтера-Клайзена): RCH2COOC2H5
+ RCH2COOC2H5 -> RCH2COCHRCOOC2Hc.
Ацетоуксусная оксокислот
и их эфи-ров-конденсация сложных эфиров карбоновых к-т под действием Na
или его алкоголятов (конденсация Гейтера-Клайзена): RCH2COOC2H5
+ RCH2COOC2H5 -> RCH2COCHRCOOC2Hc.
Ацетоуксусная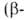 кето-масляная)
к-та СН3СОСН2СООН - вязкая жидкость; т. кип. 100
°С (с разл.); смешивается во всех соотношениях с водой, раств. в спирте,
эфире. При слабом нагревании водных р-ров, подобно формилуксусной к-те
НС(О)СН2СООН, легко декарбоксилируется с образованием ацетона.
Значительно устойчивее ее соли и особенно эфиры, из к-рых наиб. значение
имеет этиловый эфир, т.н. ацетоуксусный эфир. кето-масляная)
к-та СН3СОСН2СООН - вязкая жидкость; т. кип. 100
°С (с разл.); смешивается во всех соотношениях с водой, раств. в спирте,
эфире. При слабом нагревании водных р-ров, подобно формилуксусной к-те
НС(О)СН2СООН, легко декарбоксилируется с образованием ацетона.
Значительно устойчивее ее соли и особенно эфиры, из к-рых наиб. значение
имеет этиловый эфир, т.н. ацетоуксусный эфир.
Для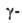 и
и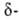 А.-
и к. характерны кето-енольная (как для ацетоуксусного эфира) и кольчато-цепная
таутомерия, напр.: А.-
и к. характерны кето-енольная (как для ацетоуксусного эфира) и кольчато-цепная
таутомерия, напр.:
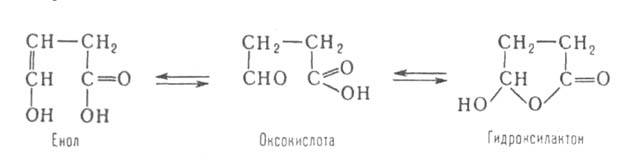
 Кетокислота
СН2=гС (СН3)СОС (ОСН3)=СНСООН Кетокислота
СН2=гС (СН3)СОС (ОСН3)=СНСООН
(пеницилловая) в кристаллич. состоянии и в водном р-ре находится в форме
гидроксилактона. Обладает св-вами антибиотиков. Простейший представитель кетокислот -левулиновая
кетокислот -левулиновая ацетилпропионо-вая) к-та СН3СОСН2СН2СООН;
т. пл. 37°С, т. кип. 246°С; d420 1,1335; пD201,396;
хорошо раств. в воде, спирте, эфире, ароматич. углеводородах;
рКа4,62
при 25°С. Получается при нагревании фруктового или тростникового сахара
с конц. НС1. М. б. синтезирована взаимод. натрийацетоуксусного эфира с
эфиром хлоруксусной к-ты с послед. кетонным расщеплением продукта конденсации:
ацетилпропионо-вая) к-та СН3СОСН2СН2СООН;
т. пл. 37°С, т. кип. 246°С; d420 1,1335; пD201,396;
хорошо раств. в воде, спирте, эфире, ароматич. углеводородах;
рКа4,62
при 25°С. Получается при нагревании фруктового или тростникового сахара
с конц. НС1. М. б. синтезирована взаимод. натрийацетоуксусного эфира с
эфиром хлоруксусной к-ты с послед. кетонным расщеплением продукта конденсации:
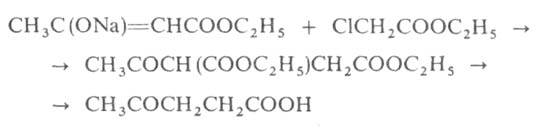
Левулиновая к-та не отщепляет самопроизвольно СО2. Как и
др. оксокислоты,
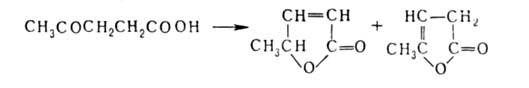
при нагревании с водоотнимающими ср-вами превращается в изомерные непредельные оксокислоты,
при нагревании с водоотнимающими ср-вами превращается в изомерные непредельные лактоны (бутенолиды):
лактоны (бутенолиды):
Применяется в произ-ве лек. ср-в, в гальванотехнике при хромировании,
как флюс для пайки.
Большое биол. значение имеют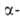 кетодикарбоновые
к-ты. Мезоксалевая (кетомалоновая) к-та НООССОСООН существует только в
виде гидрата (НО)2С(СООН)2 (т. пл. 121 °С, с разл.;
раств. в воде, спирте, эфире). Получается при гидролизе ее уреида, т. наз.
аллоксана (образуется в организме при сахарном диабете), окислении малоновой
или мочевой к-т, гидролизе диброммалоновой к-ты. Легко разлагается в водном
р-ре на глиоксалевую к-ту и СО2; обладает сильными восстановит.
св-вами. кетодикарбоновые
к-ты. Мезоксалевая (кетомалоновая) к-та НООССОСООН существует только в
виде гидрата (НО)2С(СООН)2 (т. пл. 121 °С, с разл.;
раств. в воде, спирте, эфире). Получается при гидролизе ее уреида, т. наз.
аллоксана (образуется в организме при сахарном диабете), окислении малоновой
или мочевой к-т, гидролизе диброммалоновой к-ты. Легко разлагается в водном
р-ре на глиоксалевую к-ту и СО2; обладает сильными восстановит.
св-вами.
Щавелевоуксусная к-та НООССОСН2СООН является одновременно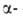 и
и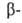 кетокислотой.
Неустойчива. В чистом виде существует исключительно в виде смеси цис-и
транс-енольных форм-гидроксималеиновой и гидрокси-фумаровой к-т. В р-рах
устанавливается равновесие между стереоизомерными енолами и кето-формой.
Играет важную роль в углеводном обмене в живых организмах. кетокислотой.
Неустойчива. В чистом виде существует исключительно в виде смеси цис-и
транс-енольных форм-гидроксималеиновой и гидрокси-фумаровой к-т. В р-рах
устанавливается равновесие между стереоизомерными енолами и кето-формой.
Играет важную роль в углеводном обмене в живых организмах.
===
Исп. литература для статьи «АЛЬДЕГИДО- И КЕТОКИСЛОТЫ»: Браун Дж. М., в кн.: Общая органическая химия, пер. с англ.,
т. 4, М., 1983, с. 195-232. Э. И. Троянский.
Страница «АЛЬДЕГИДО- И КЕТОКИСЛОТЫ» подготовлена по материалам химической энциклопедии.
|

