АЛЬДОЛАЗЫ, ферменты класса лиаз, катализирующие альдольную
конденсацию и обратную ей р-цию. Молекулы А. класса I состоят из 4 субъединиц
одинаковой мол. массы (по 30-40 тыс.). Проявляют оптим. каталитич. активность
при рН 7,0-9,0, инактивируются NaBH4. Для А. из ряда источников
определена первичная структура. наиб. изученный и распространенный представитель
-фруктозо-бисфосфат-альдолаза, к-рая при гликолизе катализирует расщепление
по одинаковой схеме фруктозе- 1,6-дифосфата и фруктозо-1-фосфата, напр.:
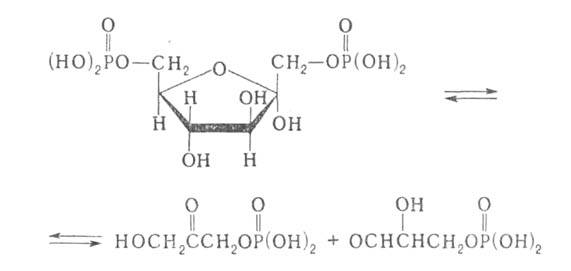
В обратной р-ции фермент обладает абс. специфичностью только в отношении
дигидроксиацетонфосфата, тогда как глицеральдегид-3-фосфат м. б. заменен
другим соед. сходной структуры. На промежуточной стадии субстрат образует
шиффово основание с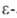 аминогруппой
лизина, находящегося в активном центре. А. теряют активность при модификации
не менее 11 остатков цистеина из 32. аминогруппой
лизина, находящегося в активном центре. А. теряют активность при модификации
не менее 11 остатков цистеина из 32.
А. класса I содержатся в тканях животных, у высших растений, а также
у нек-рых видов бактерий (напр., Pertococcus aerogenes). Ткани млекопитающих
содержат три изофермента фруктозобисфосфат-альдолазы (отличаются строением
молекулы), характерных для скелетных мышц, печени или мозга. При злокачеств.
перерождении печени в ней происходит замена своего изофермента на другой,
что используется для диагностич. целей.
Молекулы А. класса II состоят из двух субъединиц общей мол. м. 65-80
тыс. Для них характерна узкая область рН, в к-рой они проявляют оптим.
каталитич. активность; оптимальный рН существенно зависит от того, из какого
организма выделен фермент. Для проявления каталитич. св-в необходимо присутствие
ионов Zn2+ , Са2+ и Fe2+ . Ионы К+
активируют, а этилендиаминтетрауксусная к-та ингибирует эти ферменты. А.
класса II не катализируют расщепление фруктозо-1-фосфата. Содержатся в
дрожжах, грибах, бактериях и водорослях.
При недостатке в организме определенных типов А. развивается наследств.
заболевание-непереносимость фруктозы.
===
Исп. литература для статьи «АЛЬДОЛАЗЫ»: Rutter W.Y. [а.о.], в кн.: Methods in enzymology, v. 9,
N. Y.-L., 1966, p. 479-98; Morse D.E., H orecker B. L., в кн.: Advances
in enzymology and related areas of molecular biology, v. 31, N.Y.-[a.o.],
1968, p. 125-81; Horecker B.L., Tsolas O., Lai C. Y., в кн.: The enzymes,
3 ed., v. 7, N.Y., 1972, p. 213-58. В.И. Муронец.
Страница «АЛЬДОЛАЗЫ» подготовлена по материалам химической энциклопедии.
|

