| СОДЕРЖАНИЕ: |
НАУКА и ТЕХНОЛОГИИ |
ТЕНДЕНЦИИ РЫНКА |
ЭКОЛОГИЯ |
СОТРУДНИЧЕСТВО |
СОБЫТИЯ ОТРАСЛИ |
|
|
|
|
СЛОВАРЬ ТЕРМИНОВ
|
|
|
|
|
Алфавитный указатель:
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
|
ЗОЛОТО (Aurum) Au, хим. элемент I гр. периодич. системы, ат. н. 79, ат. м. 196,9665; относится к благородным металлам. В природе один стабильный изотоп 197Аu. Конфигурация внеш. электронной оболочки 5d106s1; степени окисления +1, +3, редко +5; энергии ионизации Аu0 : Аи+ : Аu2+ :
Аu3+ соотв. равны 9,2258, 20,5 и 30,5 эВ; электроотрицательность
по Полингу 2,4 сродство к электрону 2,8 эВ; атомный радиус 0,144 нм, ионные радиусы (в скобках указаны координац. числа) Аu+ 0,151 нм (6), Аu3+ 0,082 нм (4), 0,099 нм (6).
Содержание 3. в земной коре 4,3-10 % по массе, в воде морей и океанов менее 5.10-6 мг/л. Относится к рассеянным элементам. Известно более 20 минералов, из к-рых главный - самородное 3. (электрум, медистое, палладистое, висмутистое 3. и др.), представляющее собой твердый р-р Ag (от следов до 43%) в 3. и содержащее также Сu, Fе, Рb, реже - металлы платиновой группы, Mn, Bi и др. Хим. соединения 3. в природе редки, в осн. это теллуриды - калаверит АuТе2, креннерит (Au,Ag)Te2, сильванит AuAgTe4, петцит Ag3AuTe2, мутманнит (Ag,Au)Te, монтбрейит Аu2Те3 и др. 3. присутствует гл. обр. в кварце, карбонатах, пирите, арсенопирите, галените, сфалерите, халькопирите. В рудах 3. присутствует в виде вкраплений размерами б. ч. 0,1-1000 мкм, иногда находят самородки до неск. десятков кг. Генетич. типы пром. месторождений 3.: гидротермальные высокотемпературные золото-арсенопиритовой формации; гидротермальные среднетемпературные кварц-сульфидной и золото-кварцевой формаций; гидротермальные низкотемпературные золото-серебряной формации; месторождения выветривания и метаморфизованные; аллювиальные россыпи. 3. извлекают из собственно золотых руд и, попутно, из железных, медных, свинцово-цинковых и урановых руд. Мировые пром. ресурсы 3. (без СССР) ок. 65 тыс. т.
Свойства. 3. - желтый металл; кристаллич. решетка гранецентрир. кубическая, а = 0,40786 нм, z = 4, пространств. группа Fm3m. Т. пл. 1064,4 °С, т. кип. 2880 °С; плотн. твердого 3. 19,32 г/см3, жидкого 17,22 г/см3 (1100°С); С0p 25,39 Дж/(моль.К); DH0пл 12,55 кДж/моль,DH0исп 348 кДж/моль; S0298 47,40 Дж/(моль.К); ур-ния температурной зависимости давления пара: для твердого 3. lgp (гПа) = 3,94 - 19820/T - 0,3061gT - 0,16.10-3 Т (298-1337 Т), для жидкого lgp(Пa) = 10,710 + 17866/Т (1337-3150 К); температурные коэф. линейного расширения (5,98-19,10).10-6 К-1 (40-1200 К), объемного (1,79-5,73).10-5 К-1 (40-1200 К); теплопроводность 318 Вт/(м.К) при 273 К; r (2,06-2,84).10-8 Ом.м (273-373 К), температурный коэф. r 4,0.10-3 К-1 (273-373 К); диамагнетик, магн. восприимчивость —29,59.10-6. Золото - очень мягкий и пластичный металл, твердость по Моосу ~ 2,5, по Бринеллю 220-250 МПа; модуль упругости 81 ГПа; sраст 10-25 МПа.
3. устойчиво на воздухе и в воде; с О2, Н2, N2, P, Sb и С непосредственно не взаимодействует. Фосфид Аu2Р3 (DH0обр -102 кДж/моль) и антимонид AuSb2 (DH0обр - 13 кДж/моль) получают косвенным путем. 3. не раств. в р-рах щелочей и к-тах, раств. в горячей H2SeO4, смесях к-т - Н2SО4 с HNO3, H2SO4 с НМnО4, а также в царской водке (НСl + НNO3):
Аu + HNO3 + 4НСl : H[AuCl4] + NO + 2Н2О; после осторожного выпаривания выделяются желтые кристаллы комплексной золотохлористоводородной к-ты НАuСl4.3Н2О. В водных р-рах цианидов (Na, Ca, К) при доступе О2 или др. окислителей 3. раств. с образованием дицианоаурат-иона (цианирование):
2Au + 4CN- + Н2О + 0,5О2 : 2[Au(CN)2]- + 2OH-, что лежит в основе важнейшего пром. способа извлечения 3. из руд. С галогенами в отсутствие влаги 3. без нагревания не взаимод., при нагр. порошка 3. в атмосфере галогенов образуются золота галогениды. С мн. металлами 3. дает сплавы. На легком образовании амальгамы 3. основан один из методов извлечения 3. из горных пород.
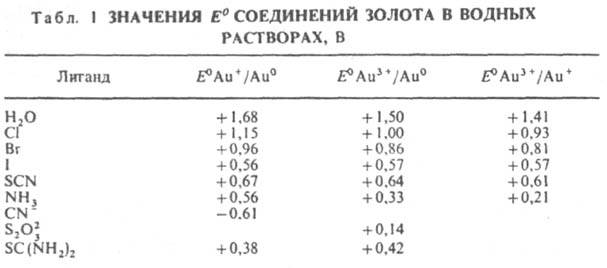
Соед. золота неустойчивы, в водных р-рах гидролизуются, легко восстанавливаются до металла. В табл. 1 приведены значения стандартных окислит.-восстановит. потенциалов E0 нек-рых соед. AuLn (где L - лиганд, п = 1,3).
Важнейшим соед. 3. посвящены отдельные статьи [см. Золота цианиды, Золотоорганические соединения, Калия дицианоаурат(I)], ниже приводятся сведения о др. соединениях 3.
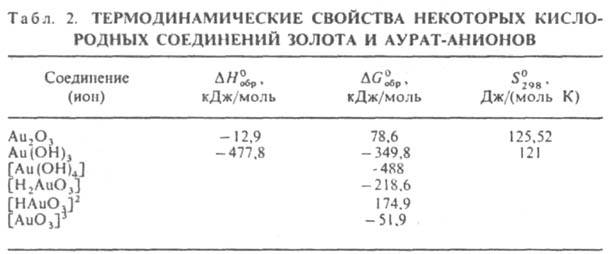
Гидроксид Au(OH)3 - темно-коричневые кристаллы; при нагр. дегидратируется с образованием сначала АuО(ОН), а затем сесквиоксида Аu2О3, к-рый выше 160°С разлагается на 3. и О2; р-римость в воде 2,4.10-12 моль/л при 20 °С, в р-рах НNО3 - до 0,38 моль/л при 25 °С, в р-рах NaOH - до 8.10-4 моль/л при 25°С. В последнем случае в р-ре 3. находится в виде гидроксоаурат-ионов [Аu(ОН)4]- (рН 7-13). Образуется Аu(ОН)3 при добавлении конц. р-ра щелочи или Mg(OH)2 к р-рам Н[АuСl4]. Ауpaты неустойчивы, легко разлагаются при нагревании. Аураты щелочных металлов хорошо раств. в воде, р-римость растет с увеличением ионного радиуса катиона; аураты Mg, Ca, Sr, Ba, Тl(I) ограниченно растворимы. Аураты с нек-рыми орг. в-вами образуют взрывчатые смеси. Предполагают, что при действии на гидроксид 3. р-ров щелочи образуются аурат-анионы [Н2АuО3]-, [HAuO3]2-, [AuO3]3-. См. также табл. 2.
Др. кислородные соед. 3. неустойчивы, легко образуют взрывчатые смеси. Соед. Аu2О3 с аммиаком Au2O3.4NH3 наз. "гремучим 3."; взрывается при 145°С, иногда и при более низких т-рах; без взрыва раств. в р-рах цианидов щелочных металлов.
Гемисульфид 3. Au2S - черно-коричневые кристаллы; DG0обр 29 кДж/моль; плохо раств. в воде (произведение р-римости 4.10-69 при 25 °С), раств. в р-рах цианидов и полисульфидов щелочных металлов. Получают взаимод. конц. р-ра K[Au(CN)2] с H2S с послед. нагреванием до кипения с избытком соляной к-ты. Сесквисульфид Au2S3 - черные кристаллы; разлагается при нагр. до 200 °С; не раств. в соляной и серной к-тах, раств. в HNO3 с выделением элементарного 3., р-рах KCN, бромной воде. Получают взаимод. H2S с АuСl3 или комплексными хлоридами 3. в безводном эфире на холоду. Известны комплексные соед., содержащие анионы [AuS3]2-, [AuS2]-, [AuS]-, [Au(SO3)2]3-, [Au(S2O3)2]3- .
Моноселенид AuSe существует в двух кристаллич. модификациях моноклинной сингонии. При обработке солянокислых р-ров 3. на холоду селеноводородом осаждается сесквиселенид Au2Se3.H2Se, устойчивый (после сушки) в интервале 40-390°С; при 535-650°C разлагается с выделением элементарного 3.
Селенат (IV) Au2(SeO3)3.3H2SeO3 лимонно-желтые кристаллы; не раств. в воде, раств. в соляной и селенистой (при нагр.) к-тах. Селенат (VI) Au2(SeO4)3 желтые кристаллы; DH0обр — 954 кДж/моль; не раств. в воде, разлагается
соляной к-той, раств. в H2SO4, HNO3 и горячей конц. H2Se04.
Теллурид (гемителлурид) АuТе2 - кристаллы от латунно-желтого до серебристо-белого цвета с металлич. блеском; плотн. 9,3 г/см, DH0обр — 11 кДж/моль; хрупок, твердость по Моосу 2,5-3.
Тиоцианат AuSCN - бесцв. кристаллы; не раств. в воде и орг. р-рителях; при 140°С разлагается до металлич. 3. и (SCN)n; под действием воды образует в р-рах прочные комплексные анионы [Au(SCN)2]- и [Au(SCN)4]- .
Коллоидное 3. При восстановлении 3. в разб. р-рах его солей, а также при электрич. распылении 3. в воде образуются коллоидные р-ры 3., окраска к-рых зависит от степени дисперсности частиц, а интенсивность окраски от их концентрации. Частицы 3. в коллоидном р-ре отрицательно заряжены. Гидрофобный золь 3. в солянокислом водном р-ре можно представить схемой:
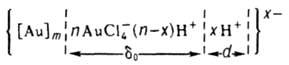
[Аu]m - ядро мицеллы (число атомов т в зависимости от условий может меняться от неск. сотен до миллионов единиц); АuСl4- - ионы, определяющие отрицательный заряд коллоидной частицы 3. и величину потенциала адсорбц. слоя толщиной d0; Н+ - противоионы, определяющие потенциал диффузионного слоя (электрокинетич. потенциал), из к-рых х ионов находится в размытой части двойного слоя толщиной d; n - кол-во ионов АuСl4-, адсорбированных на пов-сти ядра мицеллы, при этом п << т.
Получение. Источники золота - руды и пески собственно золотых россыпных и коренных месторождений (содержание 3. в них 5-15 г/т), а также промежут. продукты (0,5-3 г/т) свинцово-цинкового, медного, уранового и нек-рых др. произ-в. Из россыпей 3. извлекают гравитац. методами, используя т. н. ловушки, отсадочные машины, концентрац. смолы, шлюзы, разл. промывочные приборы. Со дна рек и озер золотоносные пески добывают и обогащают на драгах. При извлечении 3. из коренных руд используют комбинир. схемы, включающие обогатительные (гравитация, флотация) и металлургические (выщелачивание, ионообменная сорбция из пульп, цианирование, реже амальгамирование) операции. При использовании цианирования измельченную руду или концентрат обрабатывают р-ром NaCN при перемешивании; из цианистых р-ров 3. осаждают порошком Zn, с помощью ионообменных смол или активир. углей. Конечные продукты схемы - обычно гравитационный концентрат (т. н. золотая головка) и черновое 3. Очищают 3. растворением в царской водке с послед. избират. осаждением (напр., с помощью FeSO4), хлорированием в расплаве или р-ре (хлоринация) и электролитич. рафинированием в солянокислом р-ре.
Определение. Качественно 3. обнаруживают по образованию окрашенных осадков и р-ров. Используют р-ции соед. 3. с Hg2Cl2, H2O2, SnCl2, K4[Fe(CN)6], KI, бснзидином, 1-нафтиламином, о-толуидином, гваяковой смолой, комплексоном III, аскорбиновой к-той, фенилтиомочевиной, дитизоном, родамином, изохинолином и др. Можно использовать сорбцию на ионообменных смолах, а также методы электрофореза, хроматографии (круговой тoнкослойной, осадительной и распределительной), люминесценции.
Количественно 3. определяют гравиметрически (в виде металлич. 3.), титриметрически (восстановлением Аu3+ с послед. титрованием избытка восстановителя), фотометрически (по оранжевой окраске бромаурат-иона, а также по интенсивной окраске соед. 3. с разл. орг. реагентами), электрохимически, спектральными методами, методами активац., атомно-абсорбц. и пробирного анализов. Для предварит. концентрирования 3. используют хим. методы, жидкостную экстракцию и хроматографию.
Применение. 3. - валютный металл, выполняет ф-цию всеобщего эквивалента денег. 3. и его сплавы используют для декоративных целей, изготовления ювелирных изделий, монет, медалей, зубных протезов, деталей хим. аппаратуры, электрич. контактов и проводов, изделий микроэлектроники, для плакирования труб в хим. пром-сти, в произ-ве припоев, катализаторов, часов, для окрашивания стекол, изготовления перьев для авторучек, нанесения покрытий на металлич. пов-сти (в самолетостроении, космич. технике и др. областях). Искусств. радиоактивный изотоп 198Аu (T1/2 2,967 сут) используют для лечения опухолей в радиотерапии.
Мировое произ-во 3. (без СССР) ок. 1100 т/год (1984). Осн. производители - ЮАР, СССР, Канада, США, Бразилия, Австралия.
Нек-рые препараты Au(I) токсичны, накапливаются в почках, в меньшей мере - в печени, селезенке и гипоталамусе; накопление 3. в почках может привести к их заболеванию, а также к дерматитам, стоматитам, тромбоцитопении.
3. было известно человеку уже в древнейшие времена; возможно, что оно явилось первым металлом, к-рый человечество стало применять для своих потребностей. Имеются данные о добыче 3. и изготовлении из него разл. изделий в Египте (4100-3900 до н. э.), Индии, Индокитае (2000-1500 до н. э.) и др.
===
Исп. литература для статьи «ЗОЛОТО»: Бусев А. И., Иванов В. М., Аналитическая химия золота, М., 1973; Малышев В. М., Румянцев Д. В., Золото, М., 1979; Паддефет Р., Химия золота, пер. с англ., М., 1982; Благородные металлы. Справочник, под ред. Е. М. Савицкого, М., 1984; Марфунин А. С., История золота, М., 1987.
B. C. Стрижко, М. А. Меретуков.
Страница «ЗОЛОТО» подготовлена по материалам химической энциклопедии.
|
|
|
|

|
|
Куплю
19.04.2011 Белорусские рубли в Москве Москва 18.04.2011 Индустриальные масла: И-8А, ИГНЕ-68, ИГНЕ-32, ИС-20, ИГС-68,И-5А, И-40А, И-50А, ИЛС-5, ИЛС-10, ИЛС-220(Мо), ИГП, ИТД Москва 04.04.2011 Куплю Биг-Бэги, МКР на переработку. Москва |
Продам
19.04.2011 Продаем скипидар Нижний Новгород 19.04.2011 Продаем растворители Нижний Новгород 19.04.2011 Продаем бочки новые и б/у. Нижний Новгород |
|
|

