|
АЛЮМИНИЯ ХЛОРИД А1С13, бесцв. дымящие на воздухе кристаллы
с моноклинной решеткой (a = 0,591нм, b = = 1,024 нм, с =
0,616 нм,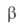 =
108,65°, z = 4, пространств. группа С2/m); т. возг. 180°С; тройная точка:
т-ра 192,5°С, давл. 0,228 МПа, плотн. 2,44 г/см3; =
108,65°, z = 4, пространств. группа С2/m); т. возг. 180°С; тройная точка:
т-ра 192,5°С, давл. 0,228 МПа, плотн. 2,44 г/см3;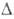 Н°пл
35,3 кДж/моль, Н°пл
35,3 кДж/моль,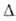 H0возг 115,7 кДж/моль (см. также табл.). В жидком
состоянии и в парах до 440°С существует в виде димера, к-рый при 440-800°С
сосуществует с мономером. При 800-1000°С стабилен только мономер.
H0возг 115,7 кДж/моль (см. также табл.). В жидком
состоянии и в парах до 440°С существует в виде димера, к-рый при 440-800°С
сосуществует с мономером. При 800-1000°С стабилен только мономер.
СВОЙСТВА ХЛОРИДА АЛЮМИНИЯ

А. х. раств. в воде (44 г в 100 г при 25°С), спирте (100 г в 100 г при
12,5 СС), ацетоне, СНС13, дихлорэтане, диэтиленгликоле,
фосгене, нитробензоле, эфире, СС14, CS2 и др.; не
раств. в бензоле, толуоле. Из водных р-ров кристаллизуется в виде желтовато-белого
расплывающегося на воздухе гексагидрата. В воде постепенно гидролизуется.
А. х.-к-та Льюиса. Образует комплексные соед. с NH3, хлоридами
и оксихлоридами (РС15, РОС13, NaCl и др.), а также
с мн. орг. в-вами. Взаимод. с расплавом А1, давая монохлорид А1С1, существующий
только в газовой фазе.
Получают А. х. действием С12 в присут. восстановителя (СО,
углерод) на обезвоженный каолин или боксит. Лаб. способ - взаимод. С12
или НС1 с А1. Гексагидрат получают р-цией А1(ОН)3 с конц. соляной
к-той с послед. высаливанием из р-ра действием НС1.
А.х.-катализатор в орг. синтезе, напр. в р-циях Фриделя-Крафтса, промежут.
продукт в произ-ве А1 методом электролиза, реагент для извлечения А1 из
сплавов и получения А1 высокой чистоты. Гексагидрат и его р-ры используют
для очистки сточных вод, обработки дерева и др.
Мировое произ-во А. х. более 140 тыс. т/год (1980).
Лит:. Фурман А. А., Неорганические хлориды, М., 1980, с. 143-79.
В. П. Данилов.
===
Исп. литература для статьи «АЛЮМИНИЯ ХЛОРИД»: нет данных
Страница «АЛЮМИНИЯ ХЛОРИД» подготовлена по материалам химической энциклопедии.
|

