|
КАДМИЙ (от греч. kadmeia - цинковая руда;
лат. Cadmium) Cd, хим. элемент II гр. периодич. системы, ат. н. 48, ат. м. 112,41.
Прир. К. состоит из восьми стабильных изотопов: 106Cd (1,22%), 108Cd
(0,88%), 110Cd (12,39%), 111Cd (12,75%), 112Cd
(24,07%), 113Cd (12,26%), 114Cd (28,85%) и 116Cd
(7,58%). Поперечное сечение захвата тепловых нейтронов для прир. смеси 29.10-26
м2, для 113Cd 25.10-25
м2. Конфигурация внеш. электронной оболочки 4d105s2;
степень окисления +2, редко +1; энергии ионизации при последоват. переходе
от Cd0 к Cd3+ соотв. 8,9939, 16,9085 и 37,48 эВ; сродство
к электрону — 0,27 эВ; электроотрицательность по Полингу 1,7; атомный радиус
0,146 нм, ионный радиус (в скобках указано координац. число) Cd2+
0,092 нм (4), 0,101 нм (5), 0,109 нм (6), 0,117 нм (7), 0,145 нм (12).
Содержание К. в земной коре 1,35.10-5%
по массе, в воде морей и океанов 0,00011 мг/л. Известно неск. очень редких минералов,
напр., гринокит CdS, oтавит CdCO3, монтепонит CdO. К. накапливается
в сульфидных рудах, в первую очередь в сфалерите (0,01-5,0%), особенно в маложелезистом,
а также в галените (до 0,02%), халькопирите (до 0,12%), пирите (до 0,02%), блеклых
рудах и станнине (до 0,2%). Извлекается попутно при переработке свинцово-цинковых
и медных руд. Общие мировые ресурсы К. оцениваются в 20 млн. т, промышленные
- в 600 тыс. т.
Свойства. К. - серебристо-белый металл с
гексагoн. плотноупакованной кристаллич. решеткой, а = 0,2979 нм, с
= 0,5618 нм, z = 2, пространств. группа С6/mmm; т. пл. 321,1°С,
т. кип. 766,5 °С; плотн. 8,65 г/см3; С0p
26,0 Дж/(моль.К);
DH0пл
6,2 кДж/моль, DH0исп
99,6 кДж/моль; S0298 51,8 Дж/(моль.К);
ур-ния температурной зависимости давления пара (в гПа): для твердого lgp = 10,173
— 5924Т + 0,172T2 + 0,642.10-2lgT
(298-595 К), для жидкого lgp = 11,47 - 5406T + 0,975Т2 (594-1040
К); температурный коэф. линейного расширения 29,0.10-6
К-1
(273 K; теплопроводность 92,85 Вт/(м.К)
при 293 К; r
7.10-6
Ом.м,
температурный коэф. r
4,0.10-3
К-1
(0-100°С). Ниже 0,519 К - сверхпроводник. Диамагнитен; магн. восприимчивость
-0,176.10-9
(20°С). Стандартный электродный потенциал -0,403 В. Мягкий
ковкий тягучий металл, хорошо вальцуется в листы, легко поддается полированию.
Палочки К. при сгибании издают треск подобно олову. Твердость по Моосу 2, по
Бринеллю (для отожженного образца) 200-275 МПа; модуль Юнга 63 ГПа; предел текучести
9,8 МПа; sраст
69 МПа; относительное удлинение 50% (20 °С). В
сухом воздухе К. устойчив, во влажном на его пов-сти медленно образуется тонкая
пленка оксида, предохраняющая металл от дальнейшего окисления. На воздухе выше
т-ры плавления К. сгорает с образованием бурого CdO (см. Кадмия оксид).
Пары К. реагируют с парами воды с выделением водорода. Медленно взаимод.
с минер. к-тами (легче всего с HNO3) с образованием солей. Соли К.
бесцветны. В р-рах молекулы мн. солей, в частности галогенидов, сильно ассоциированы;
р-ры имеют слабокислую р-цию вследствие гидролиза. При действии р-ров щелочей,
начиная с рН 7-8, осаждаются гидроксосоли. К.
восстанавливает NH4NO3 в конц. р-рах до NH4NO2.
Окисляется до Cd(II) р-рами СuСl2, солей Fe(III). С р-рами щелочей,
в отличие от Zn, не взаимодействует. Выше т-ры плавления с галогенами образует
кадмия галогениды, с халькогенами - кадмия сульфид, кадмия селенид,
кадмия теллурид. С Н2, N2, С, Si и В не реагирует.
Косвенными путями получены легко разлагающиеся
при нагр. гидрид CdH2 и нитрид Cd3N2. При сплавлении
К. с Р и As образуются соотв. фосфиды и арсениды составов Cd3Э2
и CdЭ2, с сурьмой - кадмия антимонид. Для
К. характерно образование амминов и др. комплексных соединений. Сухие соли К.
поглощают большие кол-ва NН3 - до 6 молекул на 1 молекулу соли и
более. Гидроксид Cd(OH)2 растворяется в р-рах NH3 с образованием
ионов [Cd(NH3)4]2+; при действии NH3
на р-ры солей К. в зависимости от условий могут образовываться амминокомплексы,
содержащие от 1 до 6 молекул аммиака; при кипячении р-ров они разлагаются. Труднорастворимый
цианид Cd(CN)2 с избытком цианидов щелочных металлов дает легкорастворимые
комплексные цианиды типов M2[Cd(CN)4] и M4[Cd(CN)6].
Водные р-ры амминов, комплексных цианидов, а также
комплексов К. с орг. и смешанными лигандами используют в качестве электролитов
при кадмировании - нанесении на пов-сть металлич. изделий слоя К. Кадмирование
осуществляют также пиролизом кадмийорганических соединений. При
растворении К. в расплаве его галогенидов образуется Со+ ; расплавы
при этом приобретают красно-черную окраску. При добавлении к расплаву АlНаl3
он становится желто-зеленым. В таких р-рах обнаружен ион Cd22+
. Выделено твердое желтое соед. Cd2[AlCl4]2,
к-рое при действии воды диспропорционирует с образованием Cd0 и Cd2+
. Ион Cd+ образуется также при анодной поляризации р-ров CdCl2
в ацетамиде и при импульсном радиолизе водных р-ров, содержащих Cd2+
. Важнейшим соед. К. посвящены отдельные
статьи, ниже приводятся сведения о нек-рых других. Арсенид
Cd3As2 - серые кристаллы с тетрагон. решеткой (а =
1,267 нм, с = 2,548 нм, z = 8, пространств. группа I41cd);
т. пл. 721 °С; плотн. 6,21 г/см3; DH0пл
32,1 кДж/моль, DH0обр
- 92 кДж/моль; S0298 206,8 Дж/(моль.К).
Известны и др. полиморфные модификации. Устойчив на воздухе и к действию воды,
к-тами медленно разлагается. Полупроводник; при 300 К ширина запрещенной зоны
0,425 эВ, подвижность электронов 18000 см2/(В.с).
Материал для магнеторезисторов, ИК детекторов, датчиков эффекта Холла и др.
Фосфид Cd3P2 - серые кристаллы
с тетрагон. решеткой (а = 0,8746 нм, с = 1,228 нм, z = 8,
пространств. группа Р42/nmс); т. пл. 742 °С (с разл.); плотн.
5,60 г/см3; DH0обр
— 155,2 кДж/моль. Устойчив на воздухе и в воде, к-тамй разлагается, с конц.
HNO3 реагирует со взрывом. Полупроводник; при 300 К ширина запрещенной
зоны 0,52 эВ, подвижность электронов 1500-3600 cм2/(В.с),
концентрация носителей тока (3-6).1017
см-3.
Получают сплавленисм Р и Cd или их взаимод. в парах. Перспективный лазерный
и полупроводниковый материал. Известны также CdP2, CdP4,
Cd7P10 и Cd6P7. Карбонат
CdCO3 осаждается из р-ров солей К. при действии карбонатов или гидрокарбонатов
щелочных металлов и аммония; аморфный осадок содержит примесь гидроксокарбонатов.
Безводный карбонат кристаллизуется в ромбоэдрич. решетке типа кальцита (а
= 0,6112 нм, a
= 47,4°, z = 2, пространств. группа 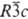 );
плотн. 5,02 г/см3; DH0обр
-755 кДж/моль; S0298 97 Дж/(моль.К).
Мало раств. в воде (2,76.10-6
% по массе при 20 °С), раств. в разб. к-тах, р-рах NH3, солей
аммония и цианидов щелочных металлов. Применяется для получения др. соед. К. );
плотн. 5,02 г/см3; DH0обр
-755 кДж/моль; S0298 97 Дж/(моль.К).
Мало раств. в воде (2,76.10-6
% по массе при 20 °С), раств. в разб. к-тах, р-рах NH3, солей
аммония и цианидов щелочных металлов. Применяется для получения др. соед. К.
Получение. Осн. источники К. - промежут.
продукты цинкового произ-ва: медно-кадмиевые кеки (осадки металлич. Cd, Сu и
Zn, полученные после очистки р-ров ZnSO4 действием цинковой пыли;
содержат 2-12% К.), пуссьеры (летучие фракции при дистилляц. получении Zn; 0,7-1,1%
К.), летучие фракции, выделенные при ректификац. очистке Zn (до 40% К.). К.
извлекают также из пылей свинцовых (содержат 0,5-5% К.) и медеплавильных (0,2-0,5%
К.) заводов. Пыли обычно обрабатывают конц. H2SO4, а затем
выщелачивают водой; из р-ров К. осаждают в виде кека вместе с медью.
Из медно-кадмиевых кеков и др. продуктов с высоким
содержанием К. его обычно выщелачивают H2SO4 при одновременной
аэрации воздухом; процесс ведут в присут. окислителя - марганцевой руды или
оборотного марганцевого шлама из электролизных ванн. Из р-ров одно- или двукратным
осаждением цинковой пылью выделяют кадмиевую губку; растворяют губку в H2SO4,
очищают р-р от примесей действием ZnO или Na2CO3, методами
ионного обмена и др. К. выделяют электролизом на алюминиевых катодах либо цементацией
на цинке (вытеснением цинком Cd0 из р-ров CdSO4) с использованием
центробежных реакторов-сепараторов. Рафинирование
металлич. К. обычно заключается в переплавке металла под слоем щелочи (для удаления
Zn и Рb), иногда с добавлением Na2CO3, обработке расплава
алюминием (для удаления Ni) и NH4Cl (для удаления Тl). К. высокой
чистоты получают электролитич. рафинированием с промежут. очисткой электролита
(ионным обменом, экстракцией и др.), ректификацией металла (обычно при пониж.
давлении), зонной плавкой или др. кристаллизац. методами. Сочетанием этих способов
получают К. с содержанием осн. примесей (Zn, Сu и др.) 10-5%
по массе. Для очистки К. могут быть также использованы методы электропереноса
в жидком К., электрорафинирования в расплаве NaOH, амальгамного электролиза.
При сочетании зонной плавки с электропереносом наряду с очисткой может происходить
и разделение изотопов К.
Определение. Качественно К. обнаруживают
после отделения др. элементов по образованию желтого осадка CdS при действии
H2S, с использованием капельных р-ций с динитро-n-дифенилкарбазидом
(фиолетово-синее окрашивание) или реактивами группы кадионов (желтое или розовое
окрашивание). Количественно определение осуществляют: комплексонометрически
- с использованием в качестве индикаторов эриохрома Т (рН 10), ксиленолового
оранжевого (рН 4,5) и др.; гравиметрически - осаждением из кислых р-ров в виде
CdS (с послед. переводом в CdSO4) или в виде комплекса с b-нафтохинолином
(C13H9NH)2CdI4; полярографически.
Для определения малых концентраций К. применяют флуоресцентные, фотометрические,
нейтронно-активационный, атомно-абсорбционный и др. методы.
Применение. К. в основном (ок. 40%) используют
для нанесения антикоррозионных покрытий на металлы. Высокая пластичность таких
покрытий обеспечивает герметичность резьбовых соединений. Кадмиевые электроды
применяют в аккумуляторах (~ 20% К.), нормальных элементах Вестона. Используют
К. для получения пигментов (~ 20%) и спец. припоев, полупроводниковых материалов,
стабилизаторов (~ 10%) пластмасс (напр., поливинилхлорида), как компонент антифрикционных,
легкоплавких и ювелирных сплавов, для изготовления регулирующих и аварийных
стержней ядерных реакторов. Мировое произ-во К. (без СССР) ок. 15000 т/год (1980).
Осн. производители -Япония, США, Бельгия, Канада, ФРГ, Австралия, Перу.
Пары К. и его соед. токсичны, причем К. может накапливаться
в организме. Симптомы острого отравления солями К. рвота и судороги. Растворимые
соед. К. после всасывания в кровь поражают центр. нервную систему, печень и
почки, нарушают фосфорно-кальциевый обмен. Хронич. отравление приводит к анемии
и разрушению костей. ПДК (рекомендованная) в сточных водах для солей 0,1 мг/л,
в питьевой воде 0,01 мг/л. К. открыл Ф.
Штромейер в 1917
===
Исп. литература для статьи «КАДМИЙ»: Дзлиев И.
И., Металлургия кадмия, М., 1962; Чижиков Д. М., Кадмий, 2 изд., М., 1967; Щербов
Д. П., Матвеец М. А., Аналитическая химия кадмия, М., 1973; Арсенид и фосфид
кадмия, Киш., 1976; Федоров П. И., Химия и технология малых металлов. Висмут
и кадмий, М., 1986, П. И. Федоров.
Страница «КАДМИЙ» подготовлена по материалам химической энциклопедии.
|

