| СОДЕРЖАНИЕ: |
НАУКА и ТЕХНОЛОГИИ |
ТЕНДЕНЦИИ РЫНКА |
ЭКОЛОГИЯ |
СОТРУДНИЧЕСТВО |
СОБЫТИЯ ОТРАСЛИ |
|
|
|
|
СЛОВАРЬ ТЕРМИНОВ
|
|
|
|
|
Алфавитный указатель:
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
|
КАЛЬЦИЯ ГАЛОГЕНИДЫ СаНаl2, бесцв. кристаллы (см. табл.). Хлорид, бромид и иодид гигроскопичны, хорошо раств. в воде, из р-ров выделяются в виде кристаллогидратов.
Расплавл. К. г. образуют с металлич. Са моногалогениды CaHal, устойчивые выше т-р плавления соответствующих дигалогенидов. О CaF2 см. в ст. Кальция фторид.
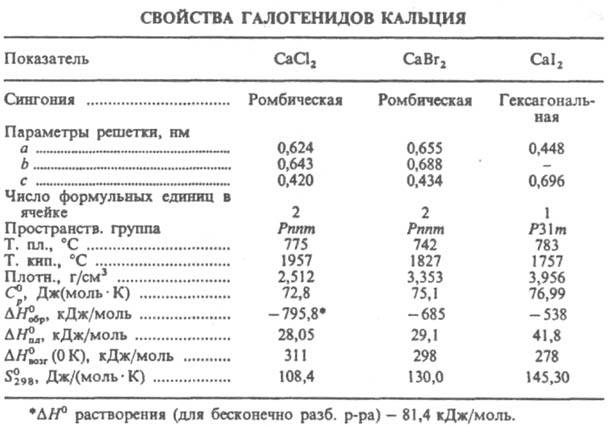
Хлорид СаСl2 энергично поглощает водяные пары, сначала образуя твердые гидраты, затем расплывается. Давление водяного пара над плавленым СаСl2 0,48 гПа. Р-римость в воде (г в 100 г): 49,6 (0°С), 74 (20 °С), 154 (99 °С); d425 10 %-, 20%-, 30%- и 40%-ных водных р-ров соотв. 1,0835, 1,1775, 1,2816 и 1,3957. Т. кип. р-ров СаСl2 120°С (40,8%-ный), 130°С (50%-ный), 175°С (75%-ный); т-ра замерзания водных р-ров -18,57 °С (20%-ный), -48 °С (30%-ный). При охлаждении конц. р-ров выпадает гексагидрат, к-рый при 30,1 °С плавится в кристаллизац. воде и переходит в тетрагидрат; последний при 45,1 °С переходит в дигидрат, к-рый при 175,9°С дает моногидрат, полностью теряющий воду выше 250 °С. При обезвоживании гидратов СаСl2 частично гидролизуется с образованием СаО и НСl. При смешении гексагидрата со снегом или мелко истолченным льдом в отношении 1 : 0,7 образуется эвтектика с т. пл. - 55 °С. Безводный СаСl2 раств. в воде с выделением тепла, гексагидрат - с поглощением тепла. СаСl2 раств. в низших спиртах и жидком NH3 с образованием сольватов, раств. также в ацетоне. Гексагидрат встречается в природе в виде редкого минерала антарктицита. Содержится в рапе нек-рых соляных озер и подземных рассолах.
Р-ры, содержащие СаСl2, получают как побочные продукты при произ-ве соды (по аммиачному способу) и бертолетовой соли. Их получают также при действии НСl на известковое молоко. Р-ры упаривают и выделяют СаСl2 в виде белой или сероватой пористой массы (плавленый
СаСl2). Применяют для получения Са и его сплавов, осушки газов и жидкостей, ускорения твердения бетона. Водный р-р - хладагент, антифриз, ср-во против обледенения летных полей аэродромов, железнодорожных рельсов и стрелок, против смерзания угля и руд, лек. ср-во при аллергич. заболеваниях, кровотечениях и др. Гексагидрат используют для приготовления охлаждающих смесей.
Бромид СаВr2 раств. в воде (59,4 г в 100 г при 0°С). Из воды кристаллизуется в виде гексагидрата (т. пл. 38,2°С). Раств. в жидком NH3 и этаноле, образуя с ними сольваты. Получают взаимод. Вr2 с известковым молоком в присут. NH3. Конц. р-ры СаВr2 применяют в качестве буровых р-ров (плотн. 50%-ного р-ра 1,635 г/см3), как теплоноситель в системах охлаждения и кондиционирования воздуха.
Иодид СаI2 раств. в воде (75,7 г в 100 г при 0°С). Кристаллизуется из воды в виде гексагидрата. Получают взаимод. СаО с иодистоводородной к-той.
===
Исп. литература для статьи «КАЛЬЦИЯ ГАЛОГЕНИДЫ»: Позин М. Е., Технология минеральных солей, 4 изд., Л., 1974; Фурман А. А., Неорганические хлориды, М., 1980.
В. И. Ксензенко, Д. С. Стасиневич.
Страница «КАЛЬЦИЯ ГАЛОГЕНИДЫ» подготовлена по материалам химической энциклопедии.
|
|
|
|

|
|
Куплю
19.04.2011 Белорусские рубли в Москве Москва 18.04.2011 Индустриальные масла: И-8А, ИГНЕ-68, ИГНЕ-32, ИС-20, ИГС-68,И-5А, И-40А, И-50А, ИЛС-5, ИЛС-10, ИЛС-220(Мо), ИГП, ИТД Москва 04.04.2011 Куплю Биг-Бэги, МКР на переработку. Москва |
Продам
19.04.2011 Продаем скипидар Нижний Новгород 19.04.2011 Продаем растворители Нижний Новгород 19.04.2011 Продаем бочки новые и б/у. Нижний Новгород |
|
|

