КАЛЬЦИЯ ЦИАНАМИД CaCN2, бесцв. кристаллы с гексагон. решеткой (а = 0,367 нм, с = 1,485 нм, z = 3, пространств. группа 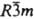 ); т. возг. 1150°С, т. пл. 1300 °С; плотн. 2,20 г/см3; DH0обр —351 кДж/моль. Раств. в воде (2,44% по массе при 25 °C), не раств. в этаноле. В водных р-рах гидролизуется с
образованием Са(ОН)2, цианамида, дициандиамида, мочевины и NH3. При 420-450 °С окисляется кислородом до СаСО3 и N2. Восстанавливается водородом до Са, С и NH3. При взаимод. с НСl при 700 °С образуются СаСl2, NH3 и ССl4, при сплавлении с углем при 1400-1500 °C - Ca(CN)2. Получают К. ц. взаимод. N2 с СаС2 при 1100°С: СаС2 + N2 D Ca(CN)2 D CaCN2 + С. Р-ция обратима и экзотермична (DH -301 кДж/моль); выше 1150°С резко увеличивается распад К. ц. на исходные в-ва с побочным образованием Ca3N2. Техн. К. ц. - темно-серый порошок, содержащий 55-65% CaCN2 (19-23% азота), СаО, углерод и др. примеси. Т. наз. белый цианамид получают при 700-900 °С по р-циям: ); т. возг. 1150°С, т. пл. 1300 °С; плотн. 2,20 г/см3; DH0обр —351 кДж/моль. Раств. в воде (2,44% по массе при 25 °C), не раств. в этаноле. В водных р-рах гидролизуется с
образованием Са(ОН)2, цианамида, дициандиамида, мочевины и NH3. При 420-450 °С окисляется кислородом до СаСО3 и N2. Восстанавливается водородом до Са, С и NH3. При взаимод. с НСl при 700 °С образуются СаСl2, NH3 и ССl4, при сплавлении с углем при 1400-1500 °C - Ca(CN)2. Получают К. ц. взаимод. N2 с СаС2 при 1100°С: СаС2 + N2 D Ca(CN)2 D CaCN2 + С. Р-ция обратима и экзотермична (DH -301 кДж/моль); выше 1150°С резко увеличивается распад К. ц. на исходные в-ва с побочным образованием Ca3N2. Техн. К. ц. - темно-серый порошок, содержащий 55-65% CaCN2 (19-23% азота), СаО, углерод и др. примеси. Т. наз. белый цианамид получают при 700-900 °С по р-циям:
СаО + 2HCN : CaCN2 + СО + Н2;
СаСO3 + 2NH3 : CaCN2 + 3Н2О;
3СаО + 6(NH2)2CO : 3CaCN2 + 3СО2 + 3Н2О +
6NH3
К. ц. применяют как азотное удобрение, дефолиант для хлопчатника и гербицид для зерновых и нек-рых овощных культур, а также для получения цианидов, дициандиамида, мочевины и др.
Токсичен. В организме превращ. в цианамид, к-рый блокирует SH-группы аминокислот и белков, образуя производные изотиомочевины. ПДК 0,0005 мг/л (в пересчете на NH2CN).
===
Исп. литература для статьи «КАЛЬЦИЯ ЦИАНАМИД»: Бобков С. С., Смирнов С. К., Синильная кислота, М., 1970.
С. К. Смирнов.
Страница «КАЛЬЦИЯ ЦИАНАМИД» подготовлена по материалам химической энциклопедии.
|

