| СОДЕРЖАНИЕ: |
НАУКА и ТЕХНОЛОГИИ |
ТЕНДЕНЦИИ РЫНКА |
ЭКОЛОГИЯ |
СОТРУДНИЧЕСТВО |
СОБЫТИЯ ОТРАСЛИ |
|
|
|
|
СЛОВАРЬ ТЕРМИНОВ
|
|
|
|
|
Алфавитный указатель:
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
|
КИСЛОТЫ НЕОРГАНИЧЕСКИЕ, неорг. в-ва, молекулы к-рых при электролитич. диссоциации в водной среде отщепляют протоны, в результате чего в р-ре образуются
гидроксоний-катионы Н3О+ и анионы кислотных остатков А-:
НА+Н2ОDН3О++А (1)
Исключение составляет борная к-та В(ОН)3, к-рая акцептирует ионы ОН-, в результате чего в водном р-ре создается избыток гидроксоний-катионов:
В(ОН)3+2Н2ОD[В(ОН)4]-+Н3О+
Число отщепляемых от молекулы к-ты протонов наз. основностью к-ты. Теории к-т и оснований (Брёнстеда, Льюиса и др.) кроме указанных выше относят к к-там мн. иные соед. (см. Кислоты и основания). Общее св-во к-т - способность реагировать с основаниями и основными оксидами с образованием солей, напр.:
HNO3+NaOH:NaNO3+Н2О 2НСl+CaO:CaCl2+H2O
К. н. подразделяют на кислородсодержащие (оксокислоты) общей ф-лы НnЭОm, где Э - кислотообразующий элемент, и бескислородные НnХ, где X - галоген, халькоген или неорг. бескислородный радикал (CN, NCS, N3 и др.). Оксокислоты характерны для мн. хим. элементов, особенно для элементов в высоких ( +3 и выше) степенях окисления.
Атомы Н в оксокислотах обычно связаны с кислородом. Если в оксокислоте имеются атомы Н, не связанные с кислородом (напр., два атома Н, образующие связи Р—Н в Н3РО2), то они не отщепляются в водном р-ре с образованием Н3О+ и не принимают участия в р-ции к-т с основаниями. Нек-рые к-ты известны в двух таутомерных формах, различающихся положением атома Н, напр.:
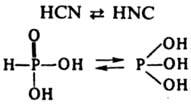
Молекулы мн. к-т содержат более одного атома кислотообразующего элемента Э. Очень многочисленны изополикислоты, содержащие атомы Э, связанные через атом кислорода, причем фрагменты —Э—О—Э— могут образовать как открытые цепи (напр., в Н4Р2О7), так и циклич. структуры [напр., в (HPO3)n]. В нек-рых к-тах содержатся цепи из одинаковых атомов, напр., цепи —S—S— в политионовых к-тах Н2SnО6 и сульфанах Н2Sn. Известны гетерополикислоты (см. Гетерополисоединения), имеющие фрагменты —Э—О—Э'—, где Э и Э' - атомы двух разных элементов, напр.: H4[SiW12O40].14H2O. Существует множество комплексных к-т, напр.: H2[SiF6], H[AuCl4], H4[Fe(CN)6]. К-ты, аналогичные оксокислотам, но содержащие вместо атома (атомов) кислорода серу, наз. тиокислотами, напр. H2S2O3, H3AsS3. Пероксокислоты, напр. H2S2O8, имеют пероксогруппы —О—О— (см. Пероксидные соединения неорганические). Константу равновесия р-ции (1) называют константой кислотности Ка. Многоосновные к-ты диссоциируют ступенчато, каждой ступени отвечает своя Ка, причем всегда Ka(1)>>Kа(2)...; ориентировочно каждая послед. Ка меньше предыдущей на 5 порядков. По значению pK1=-lgKa(1) К. н. подразделяют на очень слабые, слабые, средней силы, сильные, очень сильные (см. Кислоты и основания). Согласно правилу Полинга, для очень слабых оксокислот НnЭОm разность m-n=0, для слабых, сильных и очень сильных эта разность составляет соотв. 1, 2 и 3. Данная закономерность обусловлена сдвигом электронной плотности от связи Н—О к связям Э=О (содержащим атом О с большим значением электроотрицательности) и делокализацией электронной плотности в анионе.
Для характеристики кислотности в-в в неводных средах используют ф-цию кислотности Гаммета H0 (см. Корреляционные соотношения). Известны жидкости, для к-рых H0 более отрицательна, чем для конц. водных р-ров очень
сильных к-т, таких, как HNO3, H2SO4. Эти жидкости наз. сверхкислотами. Примеры: 100%-ная H2SO4 (H0=-12), безводная фторсульфоновая к-та HSO3F (H0=-15), смесь HF и SbF5 (H0=-17), 7%-ный р-р SbF5 в HSO3F (H0=-19,4). Эквимолярную смесь HSO3F и SbF5 называют "магической к-той". Сверхкислотность обусловлена исключительной слабостью взаимод. с протоном соответствующих анионов (HSO-4, SbF-6 и др.). В среде сверхкислот протонируются в-ва, обычно не проявляющие основных св-в, в частности углеводороды. Это явление используют на практике, преим. в орг. синтезе (алкилирование по Фриделю - Крафтсу, гидрирование нефти и др.).
Мн. оксокислоты (HNO3, HMnO4, Н2Сr2О7, НСlO и др.) - сильные окислители. окислит. активность этих к-т в водном р-ре выражена сильнее, чем у их солей. Все пероксокислоты - сильные окислители. К. н. всегда менее термически устойчивы, чем их соли, образованные активными металлами (Na, К и др.). Нек-рые К. н. (Н2СО3, H2SO3, НСlO и др.) невозможно выделить в виде индивидуальных соед., эти К. н. существуют только в р-ре.
Общие методы получения К. н.: взаимод. оксидов (ангидридов) с водой, напр.:
Р2О5+Н2О:Н3РО4
вытеснение более летучей К. н. из ее соли менее летучей К. н., напр.:
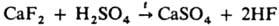
действие H2SO4 на р-р бариевой соли данной К. н., напр.:
Ва(Н2РО2)2+H2SO4:BaSO4+2Н3РО2
гидролиз галогенидов или солей, напр.:
Рl3+ЗН2O:Н3РO3+3HI Аl2Sе3+6Н2O:2Аl(ОН)3+3H2Se
замена катионов растворенных солей на Н с помощью катионита. Существует также множество др. методов получения К. н.
К. н. применяют в пром-сти и в научных исследованиях. В больших кол-вах производят серную кислоту, азотную кислоту, фосфорную кислоту, соляную кислоту и др.
===
Исп. литература для статьи «КИСЛОТЫ НЕОРГАНИЧЕСКИЕ»: Некрасов Б. В., Основы обшей химии, 3 изд., т. 1-2, М., 1973; Кемпбел Дж., Современная общая химия, пер. с англ., т. 1-3, М., 1975; Белл Р., Протон в химии, пер. с англ., М., 1977; Хьюи Д., Неорганическая химия, пер. с англ., М., 1987. С. И. Дракин.
Страница «КИСЛОТЫ НЕОРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
|
|
|
|

|
|
Куплю
19.04.2011 Белорусские рубли в Москве Москва 18.04.2011 Индустриальные масла: И-8А, ИГНЕ-68, ИГНЕ-32, ИС-20, ИГС-68,И-5А, И-40А, И-50А, ИЛС-5, ИЛС-10, ИЛС-220(Мо), ИГП, ИТД Москва 04.04.2011 Куплю Биг-Бэги, МКР на переработку. Москва |
Продам
19.04.2011 Продаем скипидар Нижний Новгород 19.04.2011 Продаем растворители Нижний Новгород 19.04.2011 Продаем бочки новые и б/у. Нижний Новгород |
|
|

