|
АДАМАНТАН (от греч. adamas, род. падеж adamantos-твердый металл;
алмаз) (трицикло[3,3,1,13,7]декан), мол. м. 136,23; бесцв. кристаллы
с запахом камфоры; т.пл. 269°С; легко возгоняется; d204
1,07;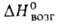 58,6 кДж/моль,
58,6 кДж/моль,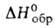 —197,2 кДж/молъ; раств. в орг. р-рителях, не раств. в 50%-ном спиоте и
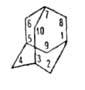
воде. Углеводный скелет А. подобен структурной единице алмаза. Жесткая,
но не напряженная молекула, включающая три конденсированных циклогексановых
кольца в конфор-мации кресла, обладает высокой симметрией (группа Td).
При 20 °С А. имеет беспорядочную гранецентриров. кубич. структуру,
переходящую при — 65°С в тетрагональную. Все длины связей С-С равны 0,154
нм, валентные углы 109,5°.
—197,2 кДж/молъ; раств. в орг. р-рителях, не раств. в 50%-ном спиоте и
воде. Углеводный скелет А. подобен структурной единице алмаза. Жесткая,
но не напряженная молекула, включающая три конденсированных циклогексановых
кольца в конфор-мации кресла, обладает высокой симметрией (группа Td).
При 20 °С А. имеет беспорядочную гранецентриров. кубич. структуру,
переходящую при — 65°С в тетрагональную. Все длины связей С-С равны 0,154
нм, валентные углы 109,5°.
Уникальное, максимально приближенное к сферическому строение А. обусловливает
особенности его св-в. Подобно алмазу, А. исключительно термостабилен (до
660 °С). Узловые атомы С (положения 1, 3, 5, 7) в А. и его производных
более реакционноспособны, чем в др. мости-ковых углеводородах. А. легко
бромируется жидким Вr2 до 1-бромадамантана. Дальнейшее бромирование,
а также хлорирование действием, напр. SOC12, СН3СОС1,
до 1-хлорадамантана происходит только в присут. к-т Льюиса. Действием 95%-ной
или 100%-ной HNO3 А. превращается соотв. в 1-адамантаннитрат
или 1,3-адамантандинитрат, к-рые легко гидролизуются в 1-гидрокси- или
1,3-дигидро-ксиадамантан. К смеси последних приводит также окисление А.
действием СгО3. Нитрование смесью HNO3-SbF5
дает 1-нитроадамантан. Алкилирование или арилирование (кат.-А1Наl3)
и карбоксилирование (кат.-8О3) приводят соотв. к 1-алкил- или
1-ариладамантану и 1-карбоксиадаман-тану, аминирование А. с помощью NC13
(кат.-к-ты Льюиса)-к 1-аминоадамантану (выход 95%). Реакц. способность
А. в этих процессах определяется необычной стабильностью адамантилий-катиона,
к-рый легко образуется под действием к-т Льюиса или сильных окислителей.
1-Брома-дамантан легко гидролизуется в водно-спиртовой среде до 1-гидроксиадамантана,
обменивает бром при нагревании с галогеноводородными к-тами на др. галоген.
1-Бром-и 1-гидроксизамещенные А.-исходные соед. для синтеза 1-амино-, 1-арил-
и 1-карбоксиадамантанов; 2-адамантанон, образующийся при нагревании А.
с конц. H2SO4, применяют для синтеза 2-гидрокси-,
2-галоген-, 2-амино- и 2-карбо-ксиадамантанов.
А. найден в нефтях нек-рых месторождений в концентрации 0,0004-0,0013%
по массе.
Получают А. гидрированием дициклопентадиена до эндотриметиленнорборнана
(трицикло[5,2,1,02,6]декана) с послед. его изомеризацией (кат.-А1Вr3,
А1С13):
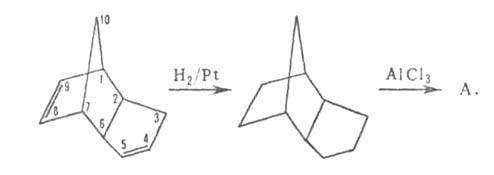
Выход 50%. Изомеризация др. полициклич. пергидроароматич. углеводородов
(напр., пергидроаценафтена, пергидроантрацена, пергидрофенантрена) приводит
к алкилпроизводным А.; выход до 90%.
Содержащие А. полимеры обладают высокими т-рами стеклования и размягчения,
низкой усадкой, прозрачностью и применяются в произ-ве оптич. стекол. Высоковязкие
р-ры полиадамантилакрилатов - загустители смазочных масел. Производные
А.-лек. в-ва (амантадин, ремантадин, троматадин).
А. впервые синтезирован В. Прелогом в 1941.
===
Исп. литература для статьи «АДАМАНТАН»: Севостьянова В. В., Краюшкин М. М., Юрченко А. Г., "Успехи
химии", 1970, т. 39, в. 10, а 1721-53; Хардин А. П.. Радченко С. С, там
же. 1982, т. 51, в. 3, с. 480-506; Багрий Е.Н., Сагинаев А.Т., там же,
1983, г. 52, в. 9, с. 1538-67; Fort R. С, Adamantane. The chemistry of
diamond molecules, N.Y., 1976. Д.В. Иоффе. Р. Я. Попова.
Страница «АДАМАНТАН» подготовлена по материалам химической энциклопедии.
|

