|
КОМПЛЕКСЫ МЕТАЛЛОВ
С РАДИКАЛЬНЫМИ ЛИГАНДАМИ, содержат в координац. сфере металла в качестве
лигандов своб. радикалы. наиб. изучены комплексы с пространственно-затрудненными
нитроксильными, феноксильными и семихиноновыми лигандами. По
типу связи металл-лиганд выделяют две основные группы. К первой относятся комплексы,
в к-рых металл непосредственно не взаимод. с радикальным центром и связь металла
с лигандом осуществляется s-
или p-связями,
а также с участием неподеленных электронных пар. К этой группе относятся соед.
с нитроксильными и феноксильными лигандами, содержащими функц. группы, такие
как азометиновая, ксантогенатная, дипиридильная, b-дикетонатная,
аллильная, порфириновая и др., напр.:
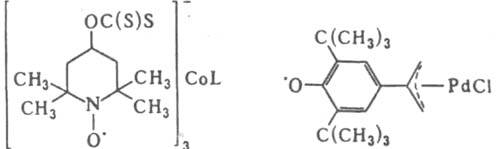
L - разл. лиганды в координац. сфере металла. Комплексы с нитроксильными лигандами получают р-циями без затрагивания своб. валентности лиганда, к-рые осуществляются традиционными для каждой функц. группы синтетич. методами, а с феноксильными - окислением диамагнитных комплексов металлов, содержащих лиганды с фенольными группами.
Методом ЭПР в комплексах этой группы обнаружено незначит. изменение распределения спиновой плотности по сравнению со своб. лигандом. В комплексах, содержащих 2-4 радикальных лиганда, обнаружен спиновый обмен неспаренных электронов лигандов, скорость к-рого определяется структурой комплекса и природой металла; в комплексах, содержащих парамагнитные ионы металла, -обмен неспаренных электронов лиганда и металла.
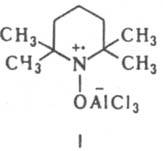
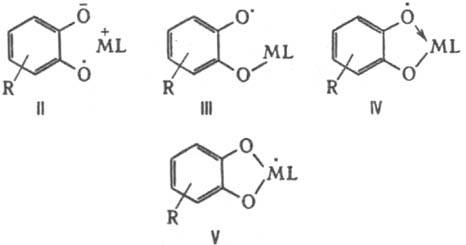
Ко второй группе относятся комплексы, в к-рых связь металл - лиганд осуществляется взаимод. орбитали радикального центра с вакантными орбиталями атома металла, напр. относительно неустойчивые комплексы нитроксильных радикалов с к-тами Льюиса (см. ф-лу I). К этой группе относятся также орто-семихиноновые системы, к-рые в зависимости от природы металла и его лигандного окружения могут находиться в виде ионных пар (ф-ла II), феноксильных радикалов (III), в к-рых возможна миграция металлоорг. фрагмента между атомами О
лиганда, хелатных комплексов (IV), в к-рых атом металла связан с атомами О лиганда тремя электронами, и комплексов со своб. валентностью на атоме металла (V):
Между этими структурами возможен переход, зависящий от природы лигандного окружения металла.
Полилкгандные семихиноновые комплексы могут существовать в виде монорадикалов, анион-радикалов и полирадикалов; для каждой из них возможен внутримол. обмен своб. валентности и связи ("блуждающая валентность"), напр.:
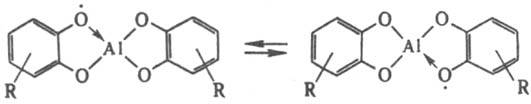
Семихиноновые комплексы получают взаимод. активных форм элементов II-IV гр. периодич. системы (напр., амальгамы металлов, белый Р, желтый As) или металлоорг. соед. с оpто-хинонами, а также обменными р-циями семихинолятов щел. металлов с галогенидами др. элементов.
===
Исп. литература для статьи «КОМПЛЕКСЫ МЕТАЛЛОВ»: Абакумов Г. А., "Ж. Всес. хим. об-ва им. Д. И. Менделеева", 1979, т. 24, № 2, с. 156-60; Милаева Е. Р. [и др.], "Успехи химии", 1982, т. 51, в. 10, с. 1638-73; Кабачник М.И. [и др.], в сб.: Итоги науки и техники. Сер. Органическая химия, т. 5, М., 1984, с. 3-130. А. И. Прокофьев.
КOМПЛЕКСЫ ПЕРЕХОДНЫХ МЕТАЛЛОВ С s- СВЯЗЬЮ МЕТАЛЛ-УГЛЕРОД, известны для всех переходных металлов, кроме технеция. Среди этих комплексов (К.) различают соед. след, типов: 1) MRn, где R - углеводородный лиганд, напр. Ti(CH2C6H5)4, W(CH3)6; 2) МКnХm, где X - ацидолиганд (остаток к-ты), напр. Ti(CH3)Cl3, W(C6H5)Cl5; 3) комплексы, содержащие помимо R т. наз. стабилизирующие лиганды (циклопентадиенил, СО, фосфины и др.) и
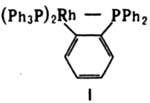
циклометаллированные системы, напр. Мо(С5Н5)(СО)3СН3, тpaнc-Pt(PPh3)2(Ph)2, соед. ф-лы I. Устойчивость К., как правило, увеличивается при переходе от К. первого типа к К. третьего типа. Роль лигандов в увеличении устойчивости сводится к блокированию
своб. координац. мест, необходимых для легкой деструкции. наиб. устойчивы К. с лигандным окружением, позволяющим металлу иметь 18-электронную оболочку следующего за ним инертного газа (правило Сиджвика). В зависимости от природы R стабильность К., как правило, уменьшается в ряду: 1-норборнил >C6H5CH2>(CH3)3SiCH2~(CH3)3CCH2>С6Н5>СН3>>C2Н5> вторичный, третичный Alk. Перфторалкильные соед. устойчивее алкильных, хелатные-нехелатных. Устойчивость К. определяется кинетич. фактором, т.е. возможностью протекания процессов разложения, имеющих низкую энергию активации. наиб. легко разложение происходит по механизму b-элиминирования алкенов:
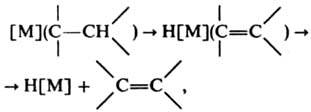
где [М] - металл с лигандным окружением. При отсутствии b - атомов водорода устойчивость К. заметно повышается и осн. путями разложения становится гомолиз связи С—М по р-ции 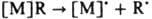 или a-элиминирование с образованием карбеновых комплексов [M]CH2CR3:H[M]=CHCR3. При наличии в координац. сфере гидридного лиганда или неск. групп R возможно восстановит. элиминирование: Н[М]R:[М]+RH и R[M]R:[М]+R2. Энергии связи С—М для К. близки к энергиям связи аналогичных соед. непереходных металлов, однако К. более неустойчивы и реакционноспособны.
Осн. хим. р-ции К.: внедрение по s-связи С—М (р-ции 1 и 2); расщепление a-связи С—М к-тами, солями Hg и галогенами (р-ции 3-5); a-p-перегруппировки при наличии в лиганде кратных связей (р-ция 6). или a-элиминирование с образованием карбеновых комплексов [M]CH2CR3:H[M]=CHCR3. При наличии в координац. сфере гидридного лиганда или неск. групп R возможно восстановит. элиминирование: Н[М]R:[М]+RH и R[M]R:[М]+R2. Энергии связи С—М для К. близки к энергиям связи аналогичных соед. непереходных металлов, однако К. более неустойчивы и реакционноспособны.
Осн. хим. р-ции К.: внедрение по s-связи С—М (р-ции 1 и 2); расщепление a-связи С—М к-тами, солями Hg и галогенами (р-ции 3-5); a-p-перегруппировки при наличии в лиганде кратных связей (р-ция 6).
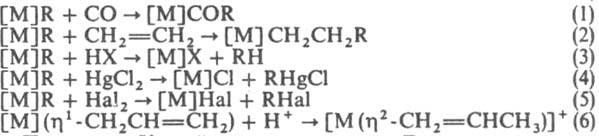
Получают К. действием реактивов Гриньяра или орг. производных металлов I и II гр. на галогенидные комплексы металлов, взаимод. анионных комплексов металлов с орг. галогенидами, окислит. присоединением орг. галогенидов к нейтральным комплексам переходных металлов в степени окисления 0 и 2, циклометаллированием, элиминированием СО или SO2 соотв. из ацильных или сульфинатных производных, внедрением олефинов по связи М—Н. К. - промежуточные соед. в промышленно важных процессах, напр. в стереоспецифич. полимеризации олефинов, их изомеризации, метатезисе и гидроформилировании. Нек-рые К. встречаются в природе, напр. соединения группы витамина В12.
Лит.: Макарова Л. Г., в кн.: Методы элементоорганической химии. h-Комплексы переходных металлов с диенами, аренами, соединения с s-связью М—С, под ред. А. Н. Несмеянова и К. А. Кочешкова, М., 1976, гл. 3, с. 229-349; Коттон Ф., Уилкинсон Дж., Основы неорганической химии, пер. с англ., М., 1979, гл. 29 31; Davidson Р. Т., Lappert М. F., Реаrсе R., "Chem. Rev.", 1976, v. 76, № 2, р.219-41 Н. А. Устынюк.
КOМПЛЕКСЫ С ПЕРЕНОСОМ ЗАРЯДА, см. Молекулярные комплексы.
Страница «КОМПЛЕКСЫ МЕТАЛЛОВ» подготовлена по материалам химической энциклопедии.
|

