| СОДЕРЖАНИЕ: |
НАУКА и ТЕХНОЛОГИИ |
ТЕНДЕНЦИИ РЫНКА |
ЭКОЛОГИЯ |
СОТРУДНИЧЕСТВО |
СОБЫТИЯ ОТРАСЛИ |
|
|
|
|
СЛОВАРЬ ТЕРМИНОВ
|
|
|
|
|
Алфавитный указатель:
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
|
КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ (комплексные соед.), содержат катионный, анионный или нейтральный комплекс, состоящий из центр. атома (или иона) и связанных с ним молекул или ионов - лигандов. Центр. атом (комплексообразователь) - обычно акцептор, а лиганды - доноры электронов, и при образовании комплекса между ними возникает донорно-акцепторная, или координационная, связь. Комплекс м. б. электронейтральным, или неэлектролитом, иметь положит. заряд (комплексный катион) или отрицательный (комплексный анион).
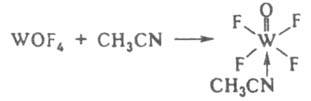
В случае образования К. с. с одноименными лигандами все связи в комплексе равноценны, если он находится в р-ре или газовой фазе, а в случае разнородных лигандов характер связи зависит от их св-в, напр. в комплексе [W(CH3CN)(O)F4] реализуются донорно-акцепторная, ковалентные простые и кратная связи:
Число атомов лигандов, координированных центр. атомом, - координационное число (к. ч.) - обычно превышает его степень окисления.
Лиганды, связанные с центр. атомом, образуют внутр. координац. сферу комплексного соединения. В р-ре комплекс
сохраняет индивидуальность, хотя может иметь место и диссоциация:
[P(CH3CN)F5]DPF5+CH3CN [Cu(en)3]2+D[Cu(en)2]2++en
(en - этилендиамин).
Анионы или катионы (противоионы), входящие вместе с комплексом в состав К. с., образуют вторую (внешнюю) сферу.
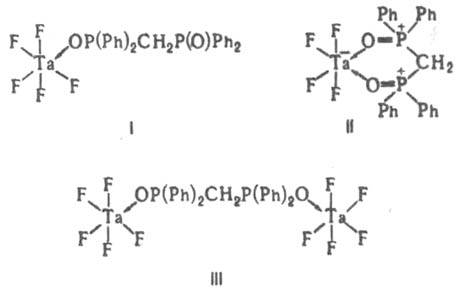
В зависимости от числа донорных атомов лиганда, способных к координации, различают моно-, би- и ... полидентатные лиганды. Лиганды, координирующиеся через два или более донорных атомов к одному центр. атому, наз. хелатными, а координирующиеся к разл. центр. ионам,-мостиковыми. Комплексы, в к-рых лиганды связывают два или более центр. ионов, наз. би- или полиядерными (многоядерными, см. Полиядерные соединения). Полиядерные комплексы, имеющие хим. связи между центр. атомами, наз. кластерами. Одни и те же лиганды, напр. Ph2P(O)CH2P(O)Ph2, в зависимости от условий могут выступать в роли монодентатных, хелатных и мостиковых (ф-лы I-III соотв.).
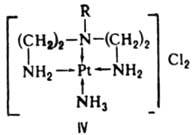
Одноатомные лиганды, напр. F-, также могут выступать в качестве мостиковых: [F5Ta—F—TaF5]-. К. с., содержащие циклич. комплексы металлов с полидентатными лигандами, в к-рых центр. атом входит в один или неск. циклов, наз. хелатами (напр., IV).
Номенклатура К. с. Назв. комплексного катиона записывают одним словом, начало к-рого составляет назв. отрицат. лигандов с прибавлением соединит. гласной "о", затем перечисляют нейтральные лиганды, именуемые как своб. молекулы, за исключением Н2О - аква, МН3 - аммин, СО - карбонил, NO - нитрозил, CS - тиокарбонил, затем называют центр. атом с послед. римской цифрой, указывающей его степень окисления. Число лигандов, назв. к-рых являются простыми словами, напр. "хлоро", "бромо", "аква", "оксалато", обозначают префиксами "ди", "три", "тстра" и т.д. Если назв. лигандов более сложны, напр. этилендиамин, триалкилфосфин, перед ними ставят префиксы "бис", "трис", "тетракис" и т.д., напр. [Co(NH3)4(NO2)Cl]NO3 нитрат хлоронитротетрамминкобальта (III).
Комплексные анионы называют согласно тем же правилам, но с добавлением суффикса "ат" к названию комплексообразователя, напр. К[Рt(НН3)Сl3] - трихлороамминплатинат (III) калия. Нейтральные К. с. обозначают одним словом, образованным по тем же правилам, напр. [Pt(PPh3)2Cl2] - дихлоро-бис-(трифенилфосфин) платина (II).
Перед назв. мостиковых лигандов ставят префикс m-, а перед ненасыщенными - префикс h- (см. Гапто-), причем, когда все атомы лиганда связаны с центр. атомом,
цифровой индекс у h не ставят, напр. m-дихлоро-бис-(h-аллил) дипалладий(II) (ф-ла V).
Формулы К. с. При написании ф-лы внутр. сферы К. с., содержащей один вид лигандов L, вначале записывают центр. атом М, а затем лиганды с указанием их числа n; всю внутр. сферу заключают в квадратные скобки. Внешнесферные катионы X (также с указанием их числа m) помещают слева от внутр. сферы, а внешнесферные анионы Y - справа: Xm[MLn], [MLn]Ym. Разные по типу заряда лиганды располагают вслед, порядке: [M(L+)(L°)(L-)]. При наличии неск. разных лигандов их отделяют друг от друга круглыми скобками, напр. запись (N2) соответствует одному лиганду диазоту, а запись (N)2 - двум лигандам.
Природа химической связи в К. с. В К. с.-хотя бы одна из связей - донорно-акцепторная, образуется в результате перекрывания заселенных электронами орбиталей лигандов с вакантными орбиталями центр. атома (см. Координационная связь). Если лиганд, как, напр., ОН-, OR-, NR-2, SR-, O2-, S2-, NR2-, имеет дополнит. неподеленные пары электронов, а центр. атом - подходящие вакантные орбитали, то образуются простые дативные связи. Лиганды, у к-рых есть вакантные орбитали (как, напр., у PR3, SR2, AsR3) с центр. атомами, имеющими d-электроны, могут образовывать обратные дативные связи p-типа. Оба эффекта приводят к упрочению координац. связи, увеличивая ее кратность.
Природу хим. связи в К. с. объясняют с помощью валентных связей метода, электростатич. теории и ее модифнкации - кристаллического поля теории, молекулярных орбиталей методов.
Строение К. с. В пространстве К. с. имеют форму многогранников - координационных полиэдров, в вершинах к-рых располагаются атомы лигандов, непосредственно связанные с центр. атомом, или неподеленные электронные пары последнего. Комплексы с к. ч. 2, напр. [CuCl2]-, [Ag(CN)2]-, имеют линейное строение, для к. ч. 3 возможно строение плоского равностороннего треугольника, как, напр., [HgI3]- (ф-ла VI) или [Pd(PPh3)3], или тригональной пирамиды. В
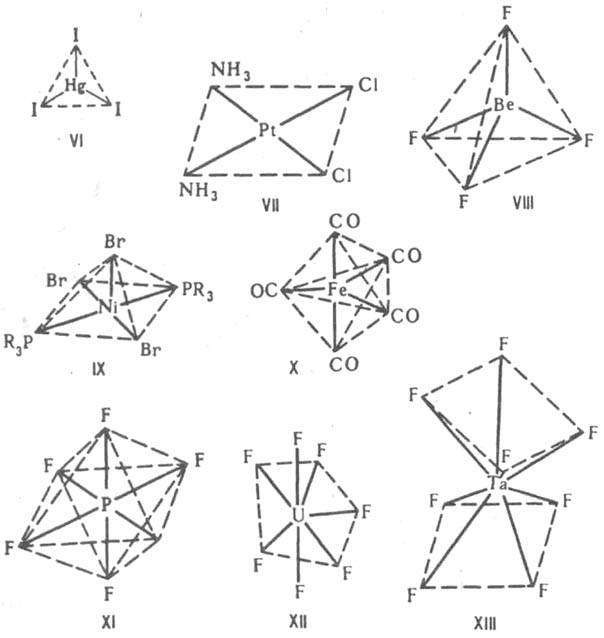
случае к. ч. 4 наиб. часто встречаются конфигурации плоского квадрата, напр. [Pt(NH3)2Cl2] (VII), или тетраэдра, напр. [BF4]-, [BeF4]2- (VIII). Для к. ч. 5 координац. полиэдрыквадратная пирамида, напр. [Ni(PR3)2Br3] (IX), или тригональная бипирамида, напр. [Fe(CO)5] (X). При к. ч. 6 координац. полиэдр обычно октаэдр, напр. [PF6]- (XI), [PtCl6]2-, однако иногда встречается и конфигурация тригональной призмы. Для к. ч. 7 известны конфигурации пентагональной бипирамиды, напр. [ZrF7]3-, [UF7]3- (XII), гранецентрир. тетрагональной призмы, напр. [NbF7]2-, или др. В случае к. ч. 8 координац. полиэдры - квадратная антипризма, напр. [TaF8]3- (XIII), или додекаэдр, напр. [Mo(CN)8]4-. Для к. ч. 9 наблюдается конфигурация гранецентрир. тригональной призмы, к-рая наиб. широко известна для аквакомплексов лантаноидов, напр. [Nd(H2O)9]3+. В случае к. ч. 10 обнаружены конфигурации додекаэдра с раздвоенными вершинами для [Nd(Me2SO4)4(NO3)3] и двушапочной антипризмы для {[Th(H2O)2(HCOO)4].H2O}.
Для предсказания конфигурации координац. полиэдра м. б. использована теория отталкивания электронных пар валентной оболочкой, согласно к-рой конфигурация комплекса определяется миним. отталкиванием всех электронных пар валентной оболочки центр. атома (см. Гиллеспи теория).
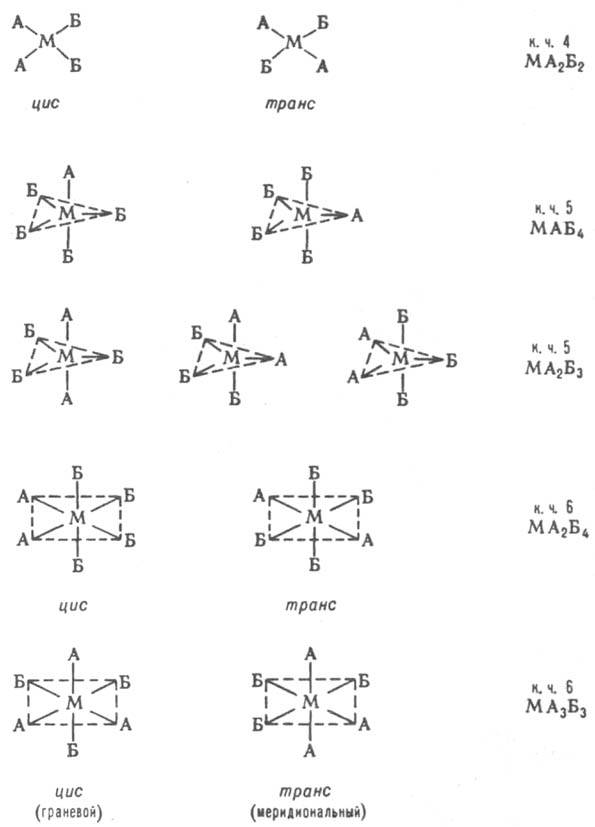
Изомерия К. с. Различают истинно изомерию комплексов, при к-рой состав внутр. сферы и строение координир. лигандов не меняется (геом., оптич., конформац., связевая), и изомерию с изменением состава координац. сферы или строения лигандов (ионизац., гидратная, координац., лигандная, формальная). Геометрическая (пространственная) изомерия является следствием разл. расположения разнородных лигандов во внутр. сфере комплексов. Возможна в случае к. ч. 4 (только для плоских квадратных комплексов) и более высоких к. ч. Ниже приведены примеры геом. изомеров.
Оптическая изомерия. Простейший пример оптически активного комплекса - тетраэдрич. структура, в к-рой центр. атом окружен четырьмя разл. лигандами или двумя несимметричными бидентатными лигандами. В случае октаэдрич. конфигурации оптич. изомеры образуют комплексы типа М(АА)3 с симметричными бидентатными лигандами, напр.:

Для комплексов типа М(АА)2В2 оптич. изомеры дают только цис-формы, поскольку транс-форма имеет плоскость симметрии, напр.:
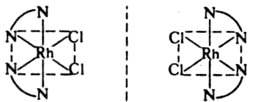
В случае октаэдрич. комплекса с 6 разнородными лигандами каждый из 15 возможных изомеров давал бы оптич. изомеры, напр.:
Конформационная изомерия - способность комплексов изменять форму координац. полиэдра, напр. переходить из плоской квадратной конфигурации в тетраэдрическую:
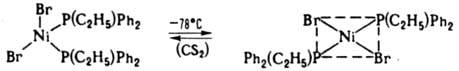
В случае связевой изомерии изменяется способ связывания монодентатно координир. лиганда, имеющего два или более неэквивалентных донорных центра, во внутр. сфере комплекса при сохранении строения лиганда. Напр., ион NCS- может координироваться через атомы N или S, NO2- - через атомы N и О, Ph2P(O)CH2C(O)NR2 - через группы Р=О или С=О, R2N(СН2)nNR'2 - через oдин из неэквивалентных атомов N и т. д.
Лигандная изомерия обусловлена существованием комплексов с изомерными формами лиганда.
Координационная изомерия заключается в полном или частичном изменении состава комплексных аниона или катиона при сохранении состава К. с., напр.:
[Co(NH3)6][Cr(C2O4)3] и [Cr(NH3)6][Co(C2O4)3]
В случае би- или полиядерных комплексов выделяют координац. изомерию положения - изменение состава координац. сфер отдельных центр. ионов при сохранении состава комплекса, напр. соед. XIV и XV.
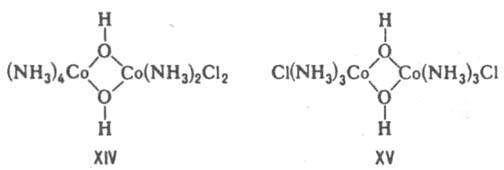
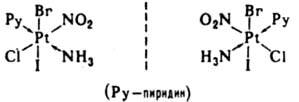
Ионизационная изомерия - способность К. с. одного состава давать в р-ре разл. ионы. Примеры ионизац. изомеров: [Pt(NH3)3Br]NO2 и [Pt(NH3)3(NO2)]Вr. Частный случай ионизац. изомерии - сольватная (гидратная) изомерия. Примеры гидратных изомеров - [Сr(Н2О)6]Сl3, [Сr(Н2O)5Сl]Сl2 Н2O, [Сr(Н2O)4Сl2]Сl 2Н2O.
Формальные изомеры - К. с. одинакового состава и мол. веса, но отличающиеся по составу лигандов, напр.: [Pt(NH3)(NH2C2H5)Cl2] и [Pt(NH2CH3)2Cl2].
Стабильность комплексов. Образование и диссоциация К. с. происходит ступенчато:
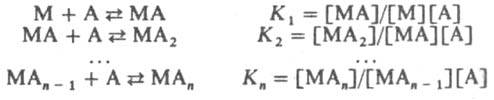
Константы К1 К2, ... ,Кn наз. ступенчатыми константами образования (устойчивости). Для обозначения полных констант образования используют символ b:
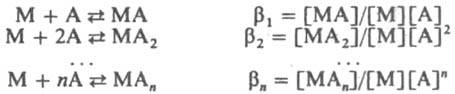
При этом bn является произведением ступенчатых констант: bn=К1К2...Кn, Константы Кn и bn - термодинамич. характеристики устойчивости комплекса в р-ре. Величины, обратные Кn или bn, наз. константами диссоциации или нестойкости.
Различают термодинамич. стабильность К. с. - меру возможности образования комплекса или его превращения в др. соед. в равновесных условиях-и кинетическую, описывающую скорость р-ций комплексов, ведущих к достижению равновесия. Термодинамич. стабильность комплекса характеризуется терминами "устойчивый", "неустойчивый", кинетическая - терминами "лабильный" и "инертный". Если при комнатной т-ре р-ция комплекса протекает за время смешения реагентов (ок. 1 мин), комплекс относят к лабильным, если р-ция протекает с измеримой скоростью и половина времени жизни комплекса более двух мин, такие комплексы наз. инертными. Напр., константа скорости изотопного обмена молекул воды во внутр. координац. сфере для инертного комплекса [Ni(H2O)6]2+ равна 3,3.104 с-1, а для лабильного [Сr(Н2О)6]3+-5.10-7 с-1.
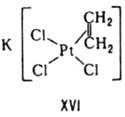
Устойчивость комплексов определяется природой центр. атома и лиганда и стерич. факторами. В соответствии с теорией "жестких" и "мягких" к-т и оснований все центр. атомы м. б. условно разделены на два класса: жесткие к-ты Льюиса и мягкие к-ты Льюиса. Первые имеют малый атомный или ионный радиус и высокую положит. степень окисления, предпочтительно взаимод. с неполяризующимися жесткими основаниями, такими как F-, ОН-, NR-2. К-ты второго класса имеют большой атомный или ионный радиус и низкую степень окисления, более эффективно взаимод. с легко поляризующимися мягкими лигандами, такими как SR2, PR3, I-, олефины. К жестким к-там Льюиса относятся центр. ионы элементов в высших степенях окисления, с электронной конфигурацией do или d10. Мягкие к-ты Льюиса имеют электроны на d-орбиталях, способные к образованию p - связей в результате перекрывания с вакантными d-орбиталями мягких лигандов. Эти же центр. ионы образуют комплексы с олефинами типа соли Цейзе (ф-ла XVI).
Поскольку р-ции комплексообразования подразумевают взаимод. к-т и оснований Льюиса, с увеличением основных св-в лигандов устойчивость комплексов повышается. Напр., в рядах доноров R3PO более сильные по основности лиганды при введении в р-р полностью замещают более слабые во внутр. сфере
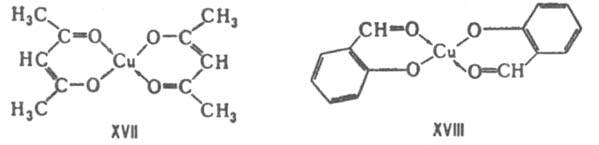
лабильных комплексов [M(OPR3)F5], где M-Nb(V), Ta(V). Комплексы хелатообразующих реагентов по сравнению с комплексами их монодентатных аналогов обладают повыш. устойчивостью (т. наз. хелатный эффект), напр. комплексы этилендиамина устойчивее, чем аммиака, причем устойчивость хелатного цикла зависит от числа атомов в нем. Для лигандов, сравнимых по основности, повышение двоесвязности в хелатном цикле приводит к повышению стабильности комплекса, напр. комплексы ацетилацетоната Си (XVII) более стабильны, чем комплексы Сu с салициловым альдегидом (XVIII). Присоединение объемного заместителя к донорному атому или вблизи него, напр. замена атома Н на алкильную группу, приводит под влиянием стерич. факторов к уменьшению стабильности комплекса, напротив, введение алкильных групп в др. положения, вследствие увеличения основности лигандов, повышает стабильность комплексов. Стерич. эффекты благоприятствуют образованию транс-изомеров.
На стабильность комплексов оказывает влияние и природа донорного атома лигандов. В случае "жестких" центр. атомов уменьшение размера донорного атома лиганда и повышение его электронной плотности приводит к увеличению стабильности комплексов, что находится в соответствии с усилением координац. связи согласно электростатич. теории, напр. стабильность галогенидных или халькогенидных комплексов падает в рядах F>Сl>Вr>I или О>S>Se~Те. В случае мягких центр. ионов наблюдается обратная тенденция: F<Cl<Вr<I. наиб. устойчивы комплексы, образуемые при координировании мягким центр. атомом лигандов с мягкими донорными центрами (атомами) и жестким центр. атомом лигандов с жесткими донорными центрами. О влиянии лигандов друг на друга (цис-влияние, транс-влияние) см. Лигандов взаимное влияние.
Реакций К. с. 1. В р-циях замещения более основный лиганд замещает менее основный или одноименный, координированный центр. атомом. Эти р-ции относятся к нуклеофильным реакциям. При диосоциативном SN1 механизме замещение протекает через медленную стадию диссоциации исходного комплекса с уменьшением к. ч. и послед. быстрой координацией входящей группы, напр.:
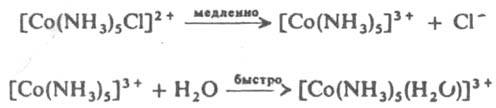
В случае октаэдрич. комплексов диссоциативный механизм SN1 предполагает образование пентакоординац. интермедиата (промежут. соед.) тетрагонально-пирамидального или тригонально-бипирамидального строения.
В случае ассоциативного SN2 механизма замещение протекает через медленную стадию образования интермедиата с увеличением к. ч. центр. иона, как, напр.:
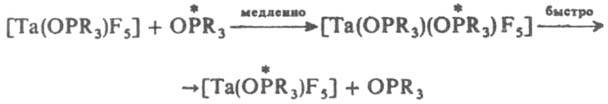
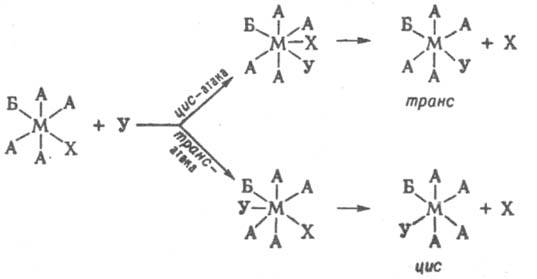
Для октаэдрич. комплексов полагают, что замещение по SN2 механизму может проходить с образованием гептакоординац. интермедиата в результате приближения входящей
группы к положению, соседнему с положением уходящего лиганда (циc-атака), или к положению, противоположному положению уходящего лиганда (транс-атака):
2. Р-ции перераспределения лигандов-один из осн. методов синтеза разнолигандных комплексов. Они могут протекать между одноименными или разноименными центр. атомами, напр.:
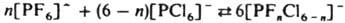
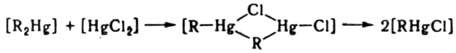
Наряду с механизмами SN1 и SN2, для этих р-ций возможен четырехцентровый механизм, при к-ром два комплекса одновременно обмениваются лигандами:
3. Р-ции внутримол. обмена приводят к наблюдаемой спектроскопич. методами (напр., ЯМР) эквивалентности лигандов, занимающих стерически разл. положения во внутр. сфере К. с. Такие р-ции могут идти без разрыва связей лигандов с центр. ионом. С высокой скоростью протекают они в К. с., имеющих строение тригональной бипирамиды. Один из возможных механизмов - псевдовращение, в соответствии с к-рым происходит парный обмен экваториальных и апикальных лигандов без разрыва связей:
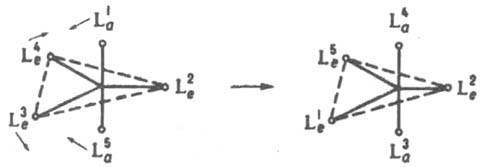
4. Р-ции изомеризации комплексов с монодентатными лигандами, напр.:
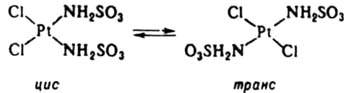
Такие р-ции могут протекать как по механизму SN1, так и без разрыва связей лигандов с центр. ионом, особенно в случае тригонально-бипирамидальных комплексов. Изомеризация октаэдрич. К. с. происходит внутри- и межмолекулярно. В случае комплексов с хелатными лигандами изомеризация протекает по внутримол. механизму SN1 с размыканием хелатного цикла и уменьшением к. ч. в интермедиате:
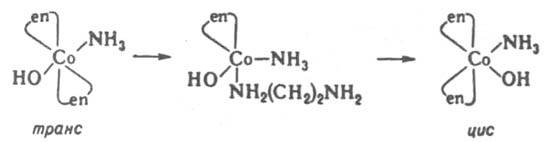
5. Р-ции координированных лигандов. а) Диссоциация лигандов - воды, спиртов, аминов и др., напр. обратимое превращение аквакомплексов в гидроксокомплексы:
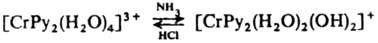
В результате диссоциации координир. молекулы воды происходит изменение характера связи атома О с центр. ионом, что может приводить к перестройке координац. сферы:
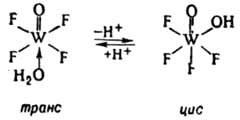
Диссоциация аква- и гидроксокомплексов может приводить к оляции - образованию полиядерных комплексов с мостиковыми атомами О или группами ОН:
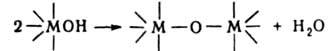
б) Окисление донорных атомов лигандов. Мягкие основания, напр. R3PS, R3PSe, R3PTe, во внутр. сфере жестких к-т Льюиса, напр. NbF5, TaF5, могут взаимод. с О2, в результате чего донорным становится более жесткий атом О:
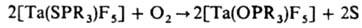
в) Изомеризация лигандов. Во внутр. сфере жестких к-т Льюиса основания мягкого типа, напр. зфиры монотиофосфиновых или монотиофосфорных к-т, могут изомеризоваться, в результате чего донорным становится более жесткий атом О и стабильность комплекса повышается:
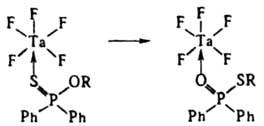
Скорость изомеризации падает с увеличением длины радикала R.
г) Р-ции присоединения и конденсации. В результате этих р-ций из координир. лигандов образуются новые лиганды, напр.:
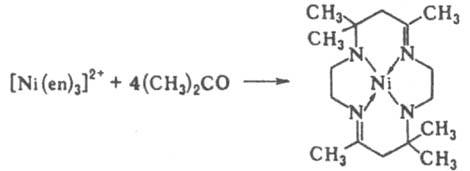
д) Р-ции внедрения молекул типа СО, C2F4, SO2, CH3CN и т. д. в комплекс по связям лиганд - центр. ион приводят к образованию новых К. с., напр.:
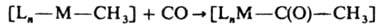
6. Окислит.-восстановит. р-ции К. с. можно разделить на два типа: а) внешнесферные, в к-рых внутр. сфера не затрагивается и промежут. ассоциаты не образуются, напр.:
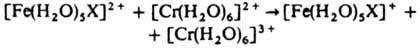
б) внутрисферные, в к-рых центр. атомы комплексов, участвующих в р-ции, связываются мостиковым лигандом, напр.:
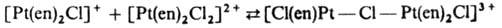
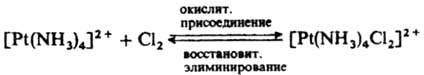
Для объяснения внешнесферного переноса электрона предложен туннельный механизм: перенос электрона может происходить на расстояниях, значительно больших, чем те, к-рые соответствуют столкновению комплексов. Если окислит. р-ция сопровождается повышением к. ч., ее наз. окислит. присоединением, обратные р-ции наз. восстановит. элиминированием:
Применение. Образование К. с. используют в экстракционных и сорбционных процессах разделения и тонкой очистки редких, цветных и благородных металлов, в аналит. химии (см. Комплексонометрия, Комплексом). К. с. применяют в качестве селективных катализаторов разл. процессов хим. и микробиол. пром-сти, для создания окислителей на основе фторидов галогенов и благородных газов, в качестве источников Н2 и О2 на основе гидридов и кислородсодержащих соед., в медицине, в т. ч. в терапии разл. видов опухолей, в качестве источников микроэлементов в животноводстве и с. х-ве, для получения тонких покрытий на разл. изделиях микроэлектроники и для придания антикоррозионных св-в и мех. прочности, и т. д. В живых организмах К. с. присутствуют в виде витаминов, комплексов нек-рых металлов (в частности, Fe, Cu, Mg, Mn, Мо, Со) с белками и др. в-вами.
См. также Аммины, Ацидокомплексы, Гетерополисоединения, Карбонилы металлов и др. О p-комплексах см. Металлоорганические соединения.
Первое К. с.-хлорид гексаамминокобальта (III) - было открыто в 1798 Б. М. Тассером. Начало развития химии К. с. было положено почти спустя столетие, когда в 1893 А. Вернер дал объяснение образования таких соед. на основе созданной им координац. теории.
Лит.: Басоло Ф., Джонсон Р., Химия координационных соединений, пер. с англ., М., 1966; Басоло Ф., Пирсон Р., Механизмы неорганических реакций, пер. с англ., М., 1971; Гринберг А. А., Введение в химию комплексных соединений, 4 изд., Л., 1971; Макаше" Ю. А., Замяткина В. М., Соединения в квадратных скобках, Л., 1976; Кукушкин Ю. Н., Химия координационных соединений, М., 1985; Берсукер И. Б., Электронное строение и свойства координационных соединений, 3 изд.,.Л., 1986; Кукушкин Ю. Н., Реакционная способность координационных соединений. Л., 1987. Ю.А. Буслаев. Е.Г. Ильин.
===
Исп. литература для статьи «КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ»: нет данных
Страница «КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.
|
|
|
|

|
|
Куплю
19.04.2011 Белорусские рубли в Москве Москва 18.04.2011 Индустриальные масла: И-8А, ИГНЕ-68, ИГНЕ-32, ИС-20, ИГС-68,И-5А, И-40А, И-50А, ИЛС-5, ИЛС-10, ИЛС-220(Мо), ИГП, ИТД Москва 04.04.2011 Куплю Биг-Бэги, МКР на переработку. Москва |
Продам
19.04.2011 Продаем скипидар Нижний Новгород 19.04.2011 Продаем растворители Нижний Новгород 19.04.2011 Продаем бочки новые и б/у. Нижний Новгород |
|
|

