|
АМИНОПЕПТИДАЗЫ, ферменты класса гидролаз, катализирующие отщепление
от пептидов N-концевых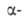 аминокислотных
остатков, а также гидролиз амидов аминокислотных
остатков, а также гидролиз амидов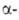 аминокислот.
Нек-рые А. обладают. большой специфичностью, напр. пролин - аминопептидаза
из Escherichia coli отщепляет только N-концевой пролин. Мол. масса А. из
разл. источников варьирует от 19 тыс. до 400 тыс. В большинстве случаев
А. содержат от 2 до 12 субъединиц. Многие А. содержат от 1 до 12 атомов
металла (обычно Mn2+ , Zn2 , Mg2+ , Ca2+
или Со2+ ), нек-рые-остатки углеводов (гексоз, глюкозаминов,
сиаловых к-т). Ингибиторы А. - пуромицин, о-фенантролин, ионы нек-рых
металлов, алифатич. амины, диазопроизводные n-аминофенилкетонов.
Последние вызывают необратимую инактивацию А. и могут быть использованы
как хромофорные метки фермента. А. содержатся в тканях животных, растений
и в микроорганизмах в растворенном или связанном с мембранами и внутриклеточными
структурами состоянии. Они играют важную роль в метаболизме белков, осуществляя
заключит. стадию их расщепления, а также в процессах превращения полипептидных
предшественников в зрелые белки. Применяются для исследования первичной
структуры пептидов. аминокислот.
Нек-рые А. обладают. большой специфичностью, напр. пролин - аминопептидаза
из Escherichia coli отщепляет только N-концевой пролин. Мол. масса А. из
разл. источников варьирует от 19 тыс. до 400 тыс. В большинстве случаев
А. содержат от 2 до 12 субъединиц. Многие А. содержат от 1 до 12 атомов
металла (обычно Mn2+ , Zn2 , Mg2+ , Ca2+
или Со2+ ), нек-рые-остатки углеводов (гексоз, глюкозаминов,
сиаловых к-т). Ингибиторы А. - пуромицин, о-фенантролин, ионы нек-рых
металлов, алифатич. амины, диазопроизводные n-аминофенилкетонов.
Последние вызывают необратимую инактивацию А. и могут быть использованы
как хромофорные метки фермента. А. содержатся в тканях животных, растений
и в микроорганизмах в растворенном или связанном с мембранами и внутриклеточными
структурами состоянии. Они играют важную роль в метаболизме белков, осуществляя
заключит. стадию их расщепления, а также в процессах превращения полипептидных
предшественников в зрелые белки. Применяются для исследования первичной
структуры пептидов.
Лит.. Колодзейская М. В., Пилявская А.С., Пептидазы, К., 1982;
The enzymes, ed. by P.D. Boyer, 3 ed., v. 3, N. Y., 1971, p. 81-112. Т.Н.
Воротынцева.
===
Исп. литература для статьи «АМИНОПЕПТИДАЗЫ»: нет данных
Страница «АМИНОПЕПТИДАЗЫ» подготовлена по материалам химической энциклопедии.
|

