| СОДЕРЖАНИЕ: |
НАУКА и ТЕХНОЛОГИИ |
ТЕНДЕНЦИИ РЫНКА |
ЭКОЛОГИЯ |
СОТРУДНИЧЕСТВО |
СОБЫТИЯ ОТРАСЛИ |
|
|
|
|
СЛОВАРЬ ТЕРМИНОВ
|
|
|
|
|
Алфавитный указатель:
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
|
КОФЕРМEНТЫ (от лат. со- - приставка, означающая совместность, и ферменты) (коэнзимы), орг. прир. соед., необходимые для осуществления каталитич. действия ферментов. Эти в-ва, в отличие от белкового компонента фермента (апофермента), имеют сравнительно небольшую мол. массу и, как правило, термостабильны. Иногда под К. подразумевают любые низкомол. в-ва, участие к-рых необходимо для проявления каталитич. действия фермента, в т. ч. и ионы, напр. К+, Mg2+ и Мn2+ . Располагаются К. в активном центре фермента и вместе с субстратом и функц. группами активного центра образуют активир. комплекс. К. должны обладать по крайней мере двумя функциональными участками или группировками, ответственными за специфич. связывание с апоферментом и субстратом.
Часто К. прочно связаны с апоферментом - образуют с ним трудно диссоциирующие или недиссоциирующие комплексы либо соединены с полипептидной цепью ковалентной связью (такие К. наз. простетич. группой). В этом случае К. обычно остаются в составе фермента на всех стадиях каталитич. р-ции. Примеры таких К. - флавиновые коферменты (см. Рибофлавин) и пиридоксаль-5'-фосфат (см. Витамин В6). Легко диссоциирующие К.-обычно К.-переносчики, действие к-рых связано с переходом от одной молекулы фермента к другой. Нек-рые К., напр. НАД (никотинамидадениндинуклеотид; см. Ниацин), в зависимости от каталитич. р-ций, в к-рых они участвуют, могут функционировать как простетич. группа или покидать активный центр фермента.
Известны десятки орг. соед., выполняющих ф-ции К. Эти в-ва, как правило, содержат системы сопряженных p-связей и (или) гетероатомы. Многие К. включают в качестве структурного компонента остаток молекулы витамина (т. наз. коферментные формы витаминов).
Различают две группы К. Относящиеся к первой группе К. участвуют в р-циях, в к-рых превращ. субстрата катализируется одним ферментом. При этом К. может регенерироваться после каждого каталитич. акта в составе фермента, катализирующего превращ. субстрата, или как косубстрат. В последнем случае регенерация К. осуществляется др. ферментом в сопряженной р-ции (в таких р-циях противопоставление К. и субстрата носит условный характер). К. второй группы участвуют в активации и переносе молекул субстрата (или их частей) от одного фермента к другому. В этом случае первоначально субстрат реагирует с К. в активном центре фермента с образованием достаточно устойчивого соед., к-рое может в неизменном виде переноситься в клетке к др. ферменту, в активном центре к-рого осуществляются каталитич. превращ. субстрата и одноврем. регенерация К.
Образование комплекса апофермента с К. - один из способов регуляции активности фермента в организме (см. Регуляторы ферментов).
Ниже рассмотрены важнейшие К. Никотинамидные К. - коферментная форма витамина ниацина. К этой группе К., универсальных по распространению (они найдены буквально во всех живых клетках) и биол. роли, относятся НАД (ф-ла I; R=Н) и никотинамидадениндинуклеотидфосфат, или НАДФ [I; R=РО(ОН)2], а также восстановленные (по пиридиновому кольцу) формы этих соед. (соотв. НАДН и НАДФН). наиб. важная биохим. ф-ция этих К. - их участие в переносе электронов и водорода от окисляющихся субстратов
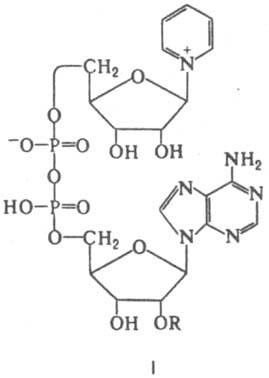
к кислороду в клеточном дыхании. При участии НАД или НАДФ, связанных прочно или легко диссоциирующих, ферменты дегидрогеназы (напр., алкогольдегидрогеназа, глутаматдегидрогеназа) катализируют обратимое превращ. спиртов, гидроксикислот и нек-рых аминокислот в соответствующие альдегиды, кетоны или кетокислоты.
Флавиновые К.-коферментная форма витамина рибофлавина. Среди оксидоредуктаз дыхательной цепи, участвующих в переносе электронов и водорода, большое значение имеют флавопротеиды-ферменты, содержащие в качестве простетич. групп флавинмононуклеотид (ФМН; IIа) и флавинадениндинуклеотид (ФАД; IIб). В нек-рых ферментах (напр., в сукцинатдегидрогеназе) ковалентная связь ФАД с апоферментом образована пирофосфатной группой К. и атомом N имадазольного кольца гистидина. Восстановление флавиновых К. осуществляется через ряд промежут. стадий, включающих образование радикалов.
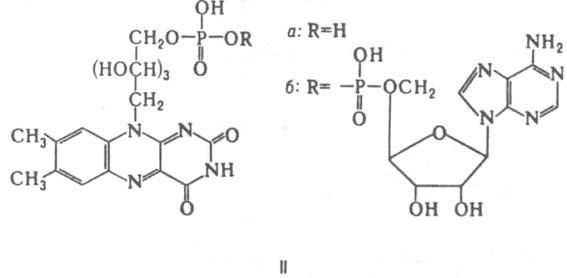
Главная ф-ция флавиновых К.-перенос электронов (водорода) в окислит.-восстановит. цепи от НАДН и янтарной к-ты к цитохромам. Флавопротеиды катализируют также многочисл. р-ции, механизм к-рых включает стадию одноэлектронного переноса; окисление восстановл. формы амида липоевой к-ты, синтез кобамидного кофермента из АТФ и витамина В12, окисление глюкозы и др.
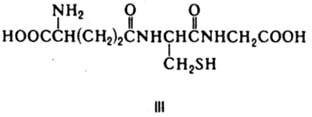
Глутатион (III)-К. нек-рых ферментов, катализирующих превращение a-диальдегидов в a-гидроксикислоты, изомеризацию производных малеиновой к-ты в производные фумаровой к-ты (малеинат - циc-транс-изомераза) и енолизацию ароматич. a-кетокислот (фенилпируваттаутомераза).
К., содержащие порфириновыи макроцикл. Эти К. в составе нек-рых ферментов (напр., цитохромы а, б и с, цитохром-с-оксидазы) участвуют в клеточном дыхании.
Аденозинтрифосфорная кислота (см. Аденозинфосфорные кислоты) - К. ферментов, катализирующих перенос гл. обр. фосфатных и пирофосфатных групп (напр., фосфотрансфераз) на разл. субстраты у всех живых организмов. Известны также случаи переноса 5'-дезоксиаденозильного остатка от АТФ с отщеплением трифосфата.
Кофермент А (КоASH, КоА; IV) - коферментная форма витамина пантотеновой кислоты. Ферменты, содержащие
этот К., катализируют р-ции, играющие важную роль в цикле трикарбоновых к-т. Этот цикл начинается с биосинтеза ацетилкофермента A [KoASC(O)CH3] в результате переноса ацетильной группы на KoASH с пировиноградной к-ты (фермент - пируватдегидрогеназа), а затем образования лимонной к-ты путем переноса ацетильной группы с
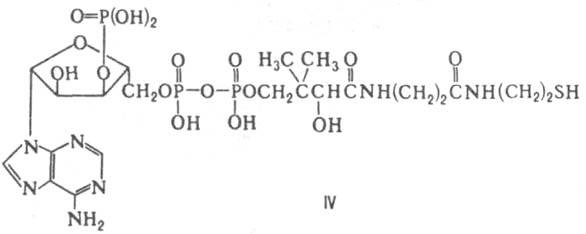
KoASC(O)CH3 на ацетилщавелевую к-ту (фермент-цитрат-синтаза). Кофермент А - также К. ферментов, участвующих в глиоксилатном цикле, окислении и синтезе жирных к-т, биосинтезе стероидов, каротиноидов, изопреноидов, нейтральных липидов и др. Во всех случаях KoASH действует как промежут. акцептор и переносчик разл. кислотных остатков, к-рые подвергаются в составе ацил - КоА тем или иным превращениям или передаются в неизменном виде на определенные метаболиты. Во всех случаях KoASH связан с ацильными остатками тиоэфирной связью.
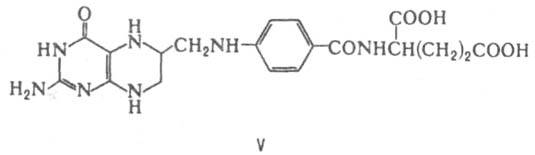
Тетрагидрофолиевая кислота (FH4; V) - коферментная форма витамина фолацина. Является К. ферментов, катализирующих перенос одноуглеродных групп [СН3, СН2, СН, СНО, СН(=NH)] в биосинтезе пуринов, пиримидинов и нек-рых аминокислот. FH4 - K. ключевых ферментов в биосинтезе гетероцикла тимидина (напр., тимидилатсинтетазы) - структурного фрагмента молекул ДНК.
Пиридоксаль-5'-фосфат (VI) коферментная форма витамина В6. Входит в состав мн. ферментов, катализирующих превращения a-аминокислот, в т. ч. их рацемизацию, переами-нирование, декарбоксилирование, элиминирование или замещение у b- и g-атомов углерода. Осн. стадия в механизме этих р-ций образование основания Шиффа в результате взаимод. a-аминогруппы
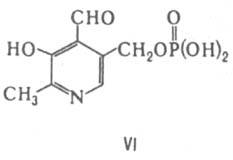
к-ты и карбонильной группы К.
(см., напр., Аспартатаминотрансфераза, Изомeразы).
Тиаминдифосфат (тиаминпирофосфат, кокарбоксилаза, ТДФ; VII) - коферментная форма витамина тиамина. К.
мн. ферментов, катализирующих превращения a-кетокислот
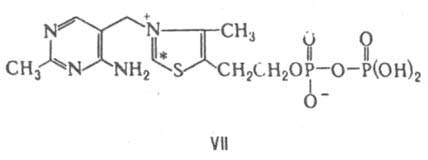
и кетоз, в т. ч. декарбоксилирование (фермент пируватдекарбоксилаза) и окислит. декарбоксилирование пировиноградной к-ты (в последнем случае с участием липоевой к-ты), при образовании и расщеплении a-гидроксикетонов и дикетонов под влиянием фосфо- и транскетолаз. Реакц. центр ТДФ - атом С в положении 2 тиазолиевого кольца (обозначен
звездочкой), к-рый легко образует карбанион в результате элиминирования Н+. Механизм каталитич. р-ции обычно включает образование ковалентной связи в результате взаимод. субстрата (или его фрагмента) с этим карбанионом.
Биотин (VIII) - К. ферментов, катализирующих перенос группы СО2 в обратимых р-циях карбоксилирования. Молекула биотина связана с апоферментом пептидной связью, образованной его карбоксильной группой и e-аминогруппой лизина в апоферменте (биотиниллизиновый остаток наз. биоцитином). Переносимая группа СО2 обратимо связывается с атомом в положении 1' биотина. Один из важных ферментов, в к-ром биотин выполняет ф-ции К., - пируваткарбоксилаза.
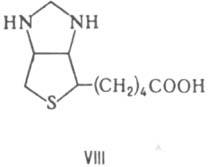
Она катализирует АТФ - зависимую
р-цию образования щавелевоуксусной к-ты из пировиноградной и HCO-3.
Кобамидные К. (кобаламиновые К., ф-лы см. в ст. Витамин В12). К этой группе относятся два К. - метилкобаламин и 5' - дезоксиаденозилкобаламин. Первый участвует в составе ферментов, катализирующих перенос групп СН3, напр. при синтезе метионина из гомоцистеина. Биол. роль второго К. состоит в участии в составе ферментов в каталитич. превращениях диолов в альдегиды (пропандиолдегидратаза), алканоламинов в альдегиды (этаноламин - аммиак-лиаза) и рибонуклеотидов в дезоксирибонуклeотиды (рибонуклеотидредуктаза), метилмалонил-кофермент А в сукцинил-кофермент А (метилмалонил-СоА-мутаза). Важная особенность этих К.-гомолиз связи Со—С в каталитич. р-циях.
Нек-рые К., напр. аденозинтрифосфорная к-та, 5'-дезок-сиаденозилкобаламин (кобамамид), тиаминдифосфат (кокарбоксилаза), флавинадениндинуклеотид (флавинат), применяют как лек. ср-ва; многие К.-лиганды в аффинной хроматографии.
===
Исп. литература для статьи «КОФЕРМEНТЫ»: Коферменты, под ред. В. А. Яковлева, М., 1973; Диксон М., Уэбб Э., Ферменты, пер. с англ., т. 1-3, М., 1982; Дюга Г., Пенни К., Биоорганическая химия, пер. с англ., М., 1983, с. 398 486; Ленинджер А.. Основы биохимии, пер. с англ., т. 1. М., 1985, с. 275-301; Общая органическая химия, пер. с англ., т. 10, М., 1986, с. 580-648. A.M. Юркевич.
Страница «КОФЕРМEНТЫ» подготовлена по материалам химической энциклопедии.
|
|
|
|

|
|
Куплю
19.04.2011 Белорусские рубли в Москве Москва 18.04.2011 Индустриальные масла: И-8А, ИГНЕ-68, ИГНЕ-32, ИС-20, ИГС-68,И-5А, И-40А, И-50А, ИЛС-5, ИЛС-10, ИЛС-220(Мо), ИГП, ИТД Москва 04.04.2011 Куплю Биг-Бэги, МКР на переработку. Москва |
Продам
19.04.2011 Продаем скипидар Нижний Новгород 19.04.2011 Продаем растворители Нижний Новгород 19.04.2011 Продаем бочки новые и б/у. Нижний Новгород |
|
|

