|
L-ЛАКТАТДЕГИДРОГЕНАЗА
(L-лактат: НАД+ оксидоредуктаза), фермент класса оксидоредуктаз,
катализирующий на последней стадии гликолиза обратимую р-цию окисления L-молочной
к-ты до пировиноградной:
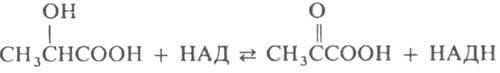
В ур-нии НАД и НАДН - соотв. окисленная и восстановленная формы никотинамидадениндинуклеотида, к-рые выполняют ф-цию кофермента. Л. окисляет также нек-рые др. L-2-гидроксикарбоновые к-ты.
Л. содержится во всех живых организмах, гл. обр. в цитоплазме клеток. Фермент животных - тетрамер, состоящий из одинаковых субъединиц (Н4 или М4) либо из их сочетаний (Н3М, Н2М2, НМ3). В тканях с аэробным обменом (сердце, печень) преобладает тетрамер Н4, характеризующийся макс. электрофоретич. подвижностью среди всех изоферментных форм Л.; в скелетных мышцах - форма М4, обладающая миним. подвижностью. Изофермент Н4 предпочтительно катализирует окисление молочной к-ты в мышечной ткани сердца, а М4 - восстановление пировиноградной к-ты в скелетных мышцах при низкой концентрации субстрата. У Л. из мышц (мол. м. 140 тыс.) оптим. каталитич. активность при рН 7,4-8,5; рI 4,5.
В Л. имеется общий для мн. дегидрогеназ (катализируют окислит. - восстановит. р-ции с переносом водорода от одного соед. к другому) структурный фрагмент, связывающий НАД, к-рый состоит из 6 плотно упакованных параллельных b-цепей и неск. a-спиральных участков. Первичная структура определена для Л. из ряда источников (для Л. из акулы изучены структура активного центра и механизм каталитич. действия). Ингибиторы Л. - соед., реагирующие с группой SH, и гидроксиламин.
Определение спектра изоферментного состава Л. в плазме крови используют для диагностики нек-рых болезней печени (напр., инфекц. гепатита) и сердца.
===
Исп. литература для статьи «L-ЛАКТАТДЕГИДРОГЕНАЗА»: The enzymes, 3 ed., v. II, pt A, N.Y., 1975, p. 191-292.
T. H. Дружинина.
Страница «L-ЛАКТАТДЕГИДРОГЕНАЗА» подготовлена по материалам химической энциклопедии.
|

