|
АММОНИЕВЫЕ СОЕДИНЕНИЯ, содержат положительно заряженный
атом N, связанный ковалентно с орг. остатками и (или) водородом и ионной
связью с анионом.
Простейшие неорг. А. с.-гидроксид и соли аммония (см., напр., Аммония
нитрат, Аммония сульфат).
Орг. А. с. в зависимости от числа орг. остатков у атома N подразделяют
на первичные [RNH3]+X-, вторичные [R2NH2]+X-,
третичные [R3NH]+X- и четвертичные [R4N]+X-.
Соед. с пятиковалентным атомом N не существует. Известны внутр. четвертичные
аммониевые соли, напр. бетаин (СН3)3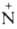 СН2СОО-.
К А. с. часто относят все орг. соед., содержащие ониевый атом N, напр.
соли пиридиния и др. гетероциклич. производных, гидразиния, гидроксиламмония,
нитрилия [RC СН2СОО-.
К А. с. часто относят все орг. соед., содержащие ониевый атом N, напр.
соли пиридиния и др. гетероциклич. производных, гидразиния, гидроксиламмония,
нитрилия [RC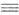 NR']
+
X -. NR']
+
X -.
Обычно первичные, вторичные и третичные аммониевые соли рассматривают
как соли аминов. Они образуются при взаимод. аминов с к-тами. Под действием
р-ров щелочей из солей аминов, к-рые являются слабыми основаниями и не
раств. в воде, выделяется исходный амин; соли аминов, обладающих сильными
основными св-вами и растворяющихся в воде, превращаются в гидроксиды, к-рые
устойчивы только в водных р-рах и уже при их упаривании легко теряют Н2О,"
давая исходный амин. Этот прием используется для очистки аминов. К ониевым
соед. относят обычно только четвертичные аммониевые соли.
Четвертичные аммониевые соли-кристаллы. Их получают гл. обр. алкилированием
(т. наз. кватернизация) третичных аминов алкилгалогенидами: R3N
+ R'X -> [R3NR']+X-. Скорость р-ции убывает
в ряду: иодиды > бромиды > хлориды и резко возрастает при использовании
биполярных апротонных р-рителей, напр. ДМСО, ДМФА. Алкилирующими агентами
м. б. также диалкилсульфаты, эфиры арилсульфоновых к-т и др.
Особый тип солей аммония -иминиевые соли.
При действии р-ров едких щелочей на четвертичные соли образуются четвертичные
аммониевые основания, равные по силе КОН и NaOH (поэтому р-ция равновесна):
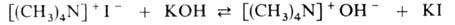
Чистые основания обычно получают действием AgOH на четвертичные соли:
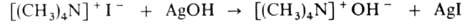
Четвертичные аммониевые основания-кристаллы, расплывающиеся на воздухе.
При 100-150°С разлагаются, причем по-разному в зависимости от строения
радикалов. Так, из [(CH3)4N]+OH-
или [(C6H5CH2)4N]+ОН-
образуются третичные амины и спирты. При наличии атома Н в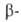 положении
по отношению к атому N распад идет с выделением третичного амина, олефина
и воды (расщепление по Гофману): положении
по отношению к атому N распад идет с выделением третичного амина, олефина
и воды (расщепление по Гофману):
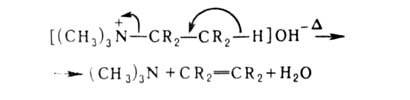
В смеси безводных ТГФ и ДМСО четвертичные основания расщепляются уже
при комнатной т-ре.
Метилирование амина до четвертичной аммониевой соли (кватернизация),
превращение последней в основание и его распад (метод исчерпывающего метилирования)
применяются при изучении прир. алкалоидов и др. азотистых оснований.
При действии C6H5Li на [(CH3)4N]+C1-
от одного из атомов углерода отщепляется атом Н и образуется триметиламмонийметилид
(СН3)3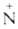 —СН2-внутренняя
аммониевая соль. Подобные илиды образуются при Стивенса перегруппировке.
Напр.,
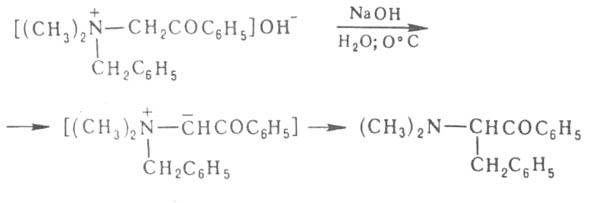
гидроксид фенацилбензилдиметиламмония в водном р-ре гладко превращается
в —СН2-внутренняя
аммониевая соль. Подобные илиды образуются при Стивенса перегруппировке.
Напр.,
гидроксид фенацилбензилдиметиламмония в водном р-ре гладко превращается
в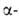 бензил- бензил-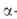 диметиламиноацетофенон:
диметиламиноацетофенон:
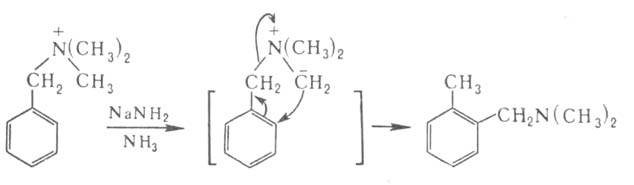
Соли бензиламмониев могут претерпевать и перегруппировку Соммле-Хаузера:
При восстановлении четвертичных солей, содержащих двойную связь в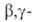 положении,
расщепляется связь С—N: положении,
расщепляется связь С—N:
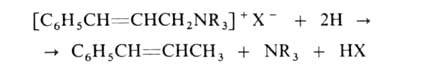
Четвертичные аммониевые соли, содержащие хотя бы одну длинную алкильную
цепь, обладают поверхностно-активными и антисептич. св-вами; их применяют
как эмульгаторы, стабилизаторы, смачиватели, дезинфицирующие ср-ва. Четвертичные
соли используются как лек. препараты (метацин, кватерон, бензогексоний
и др.), как катализаторы межфазного переноса. Четвертичные основания, напр.
[(CH3)4N]+ОН- (тритон В), [(CH3)2N
(CH2C6H5)2]+ОН-(тритон
Г), - р-рители для целлюлозы; применяются также для омыления жиров и др.
Орг. А. с. встречаются в природе. Так, во мн. растениях содержатся алкалоиды
в виде солей; простейшая четвертичная соль [(CH3)4N]+X-
найдена в морских анемонах и нек-рых растениях; холин [(CH3)3NCH2CH2OH]+OH-и
ацетилхолин-важные физиологические активные соединения.
===
Исп. литература для статьи «АММОНИЕВЫЕ СОЕДИНЕНИЯ»: Яновская Л.А., Юфит С.С., Органический синтез в двухфазных
системах, М., 1982; Юфит С. С., Механизм межфазного катализа, М., 1984;
Общая органическая химия, пер. с англ., т. 3, М., 1982; Вебер В., Гркель
Г., Межфазный катализ в органическом синтезе, пер. с англ., М., 1980; Kirk-Othmer
encyclopedia, 3 ed., v. 2, N.Y.-[a.o.], 1978, p. 516-36. Т.П. Толстая.
Страница «АММОНИЕВЫЕ СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.
|

