|
АММОНИЯ КАРБОНАТ (NH4)2CO3,
бесцв. кристаллы, решетка кубическая;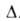 Н°^
-942,8
кДж/моль, Н°^
-942,8
кДж/моль,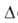 G°обр
-687,1
кДж/моль; S°298 170 ДжДмоль*К). Неустойчив, уже ок. 20°С разлагается
с образованием NH3 и гидрокарбоната. Получают: взаимод. газообразных
NH3, СО2 и паров воды, взятых в стехиометрич. кол-вах,
при быстром охлаждении и конденсации продуктов р-ции; пропусканием СО2
через водные р-ры NH3. Применяют для получения др. солей
аммония, как ускоритель ферментации в произ-ве вина, компонент огнетушащих
составов, реагент при очистке пром. газов от H2S и сераорг.
соединений. G°обр
-687,1
кДж/моль; S°298 170 ДжДмоль*К). Неустойчив, уже ок. 20°С разлагается
с образованием NH3 и гидрокарбоната. Получают: взаимод. газообразных
NH3, СО2 и паров воды, взятых в стехиометрич. кол-вах,
при быстром охлаждении и конденсации продуктов р-ции; пропусканием СО2
через водные р-ры NH3. Применяют для получения др. солей
аммония, как ускоритель ферментации в произ-ве вина, компонент огнетушащих
составов, реагент при очистке пром. газов от H2S и сераорг.
соединений.
Гидрокарбонат NH4HCO3 - бесцв. кристаллы, решетка
ромбическая (а = 0,876 нм, b = 0,1079 нм, с = = 0,729
нм, z = 8, пространств. группа Рлаа); d4° 1,586;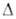 Нообр
- 849,9 кДж/моль, Нообр
- 849,9 кДж/моль, Gообр
- 666,5 кДж/моль; Sо298 119,7 ДжДмоль*К). Начинает
разлагаться с выделением СО2 уже ок. 20°С; давление разложения
(кПа): 7,859 (25,4оС), 37,03 (45°С), 108,56 (59,3 °С). Р-римость
в воде (г в 100г): 11,9 (0°С), 21 (20°С), 27 (30°С), 36,6 (40°С); выше
40°С в водных р-рах разлагается. Получают при пропускании СО2
через водные р-ры (NH4)2CO3. Применяют
для получения др. солей аммония, в производстве красителей, как компонент
огнетушащих составов, при выпечке хлеба и кондитерских изделий в качестве
разрыхлителя теста. Gообр
- 666,5 кДж/моль; Sо298 119,7 ДжДмоль*К). Начинает
разлагаться с выделением СО2 уже ок. 20°С; давление разложения
(кПа): 7,859 (25,4оС), 37,03 (45°С), 108,56 (59,3 °С). Р-римость
в воде (г в 100г): 11,9 (0°С), 21 (20°С), 27 (30°С), 36,6 (40°С); выше
40°С в водных р-рах разлагается. Получают при пропускании СО2
через водные р-ры (NH4)2CO3. Применяют
для получения др. солей аммония, в производстве красителей, как компонент
огнетушащих составов, при выпечке хлеба и кондитерских изделий в качестве
разрыхлителя теста.
В водных р-рах СО2 и NH3 образуется также сескви-карбонат
(NH4)2CO3*2NH4HCO3*H2O.
С.А.
Крашенинников.
===
Исп. литература для статьи «АММОНИЯ КАРБОНАТ»: нет данных
Страница «АММОНИЯ КАРБОНАТ» подготовлена по материалам химической энциклопедии.
|

