|
АММОНИЯ ТИОЦИАНАТ (роданид аммония) NH4NCS, бесцв.
гигроскопичные кристаллы. До 92 °С устойчива модификация с моноклинной
решеткой, выше 92°С - с ромбической. Т. пл. 149,6°С, выше 140°С частично
превращ. в (NH2)2CS, выше 170°С разлагается; плотн.
1,3057 г/см3;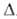 Нообр
- 82,0 кДж/моль. Раств. в воде (54,9% при 0°С, 61,9% при 20°С) с большим
поглощением тепла, в жидком NH3, спирте и ацетоне; при — 25,2
°С образует гидрат NH4NCS*5,851H2O, в атмосфере NH3
-
аммиакаты NH4NCS*nNH3 (n= 1-8). Получают А.т. взаимод.
NH3 с CS2 и при улавливании цианистых соед., содержащихся
в коксовом газе, р-рами полисульфида аммония с послед. выделением и очисткой.
А. т.-реагент для аппретирования и печатания тканей, разделения Zr и Hf,
травления железа и стали; компонент электролитов в гальванопластике, проявителей
в фотографии, охлаждающих р-ров; реактив для роданометрич. и меркуриметрич.
анализов галогенов и цианидов, гравиметрич. определения Cu2+,
Zn2+ и Cd2+, фотоколориметрич. определения Fe, Co,
Мо и др. Его используют также для получения др. тиоцианатов. Комплексные
соед., образуемые А. т., напр. соль Рейнеке NH4[Cr(NH3)2(NCS)4]*H2O,
используют для качеств. определения ряда катионов элементов I-III и VIII
групп. Нообр
- 82,0 кДж/моль. Раств. в воде (54,9% при 0°С, 61,9% при 20°С) с большим
поглощением тепла, в жидком NH3, спирте и ацетоне; при — 25,2
°С образует гидрат NH4NCS*5,851H2O, в атмосфере NH3
-
аммиакаты NH4NCS*nNH3 (n= 1-8). Получают А.т. взаимод.
NH3 с CS2 и при улавливании цианистых соед., содержащихся
в коксовом газе, р-рами полисульфида аммония с послед. выделением и очисткой.
А. т.-реагент для аппретирования и печатания тканей, разделения Zr и Hf,
травления железа и стали; компонент электролитов в гальванопластике, проявителей
в фотографии, охлаждающих р-ров; реактив для роданометрич. и меркуриметрич.
анализов галогенов и цианидов, гравиметрич. определения Cu2+,
Zn2+ и Cd2+, фотоколориметрич. определения Fe, Co,
Мо и др. Его используют также для получения др. тиоцианатов. Комплексные
соед., образуемые А. т., напр. соль Рейнеке NH4[Cr(NH3)2(NCS)4]*H2O,
используют для качеств. определения ряда катионов элементов I-III и VIII
групп.
А.т. слабо токсичен. ЛД50 720 мг/кг (мыши, перорально). У
человека раздражает кожу, вызывает ксантопсию (видение предметов в желтом
цвете); при длит. воздействии угнетает щитовидную железу, поражает почки.
Р-ры А. т. корродируют Си, Fe и нек-рые хромоникелевые сплавы; практически
не действуют на А1.
===
Исп. литература для статьи «АММОНИЯ ТИОЦИАНАТ»: Химия псевдогалогенидов, пер. с нем. К., 1981. С.К.
Смирнов.
Страница «АММОНИЯ ТИОЦИАНАТ» подготовлена по материалам химической энциклопедии.
|

