|
МEЙЕРА РЕАКЦИЯ, получение
алифатич. нитросоедине-ний действием AgNO2 на первичные алкилгалогениды
(обычно бромиды и иодиды, реже - хлориды):
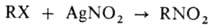
Осуществляют М.р. чаще
всего в абс. эфире, иногда в петролейном эфире или ацетонитриле при 0-20 °С.
Высокий выход нитроалканов (до 80%) дают первичные неразветвленные или разветвленные
в b-положении алкилгалогениды, напр. гексилбромид, изобутилхлорид и др. Разветвленные
в a-положении галогениды (напр., изопропилбромид) образуют нитроалканы с низкими
выходами или вовсе не дают желаемых продуктов (напр., неопентилбромид). Р-ция
со вторичными и третичными алкилгалогенидами также идет с низкими выходами,
к-рые обычно не превышают соотв. 25 и 4-6%. С алкилгалогенидами, содержащими
различные функциональные группы, р-ция протекает с хорошим выходом. Так, эфиры
a-галогенокислот в М.р. образуют соответствующие эфиры a-нитрокислот с выходом
75-84%, напр.:
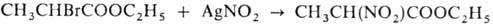
Первичные дигалогениды
превращ. в динитроалканы:
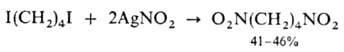
В М.р. вступают также алициклич.,
жирно-ароматич. и нек-рые гетероциклич. галогениды, напр.:
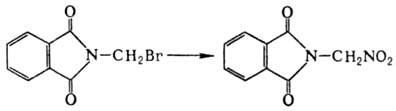
Побочные продукты-нитриты
и нитраты.
Модификация М. р.-действие
на алкилгалогениды р-ров NaNO2(KNO2) в ДМСО или ДМФА (модификация
Корн-блюма). Такой метод позволяет с выходом 55-65% получать вторичные нитросоединения
разл. типов. Др. модификация-проведение р-ции в условиях межфазного катализа.
Так, взаимод. алкил- или бензилгалогенидов с NaNO2 в ацетонитриле
в присут. 18-краун-6-эфира приводит к получению нитроалканов с выходом 65-70%.
М. р. используется в осн.
для получения первичных нитроалканов. Р-ция открыта В. Мейером в 1872.
===
Исп. литература для статьи «МEЙЕРА РЕАКЦИЯ»: Корнблюм Н.,
в кн.: Органические реакции, сб. 12, М., 1965, с. 117-55; Вацуро К. В., Мищенко
Г. Л., Именные реакции в органической химии, М., 1976; Houben- Weyl, Methoden
der organischen Chemie, 4 Aufl., Bd 10, Tl 1, Stuttg., 1971, S. 46. Л. А.
Яновская.
Страница «МEЙЕРА РЕАКЦИЯ» подготовлена по материалам химической энциклопедии.
|

