|
МЕТАЛЛООРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ, содержат в молекуле связь металл - углерод (М—С). Цианиды,
карбиды, а в нек-рых случаях и карбонилы металлов, также содержащие связь М—С,
считают неорг. соединениями. К М.с. иногда относят орг. соед. В, Si, As и нек-рых
др. неметаллов. В связи с этим в СССР используют более общий термин - элементоорганические
соединения.
Первое М.с. (соль Цейзе
K[PtCl3(CH2=CH2)].H2O)
получено В. Цейзе в 1827. Впоследствии работами Р. Бунзена, выделившего орг.
соед. As (1839), и Э. Франкленда, получившего диэтилцинк (1849), положено начало
химии М.с. С сер. 19 в. до сер. 20 в. развивалась преим. химия соед. непереходных
металлов. Главное достижение этого периода-синтез и широкое применение магнийорг.
соед. (реактивы Гриньяра, см. Гриньяра реакция). В 50-х гг. 20 в. произошел
резкий подъем в химии М. с., особенно переходных металлов. За открытием и установлением
строения ферроцена (1951) последовал синтез и выделение множества родственных
металлоорг. комплексов. Этому способствовало развитие и внедрение физ. методов
исследования, а также успешное применение М.с. в практике.
По характеру связи металл
- углерод М.с. разделяют на неск. типов. 1) Соед. с s-связями М—С, в к-рых орг.
группа связана с металлом двухэлектронной двухцентровой ко-валентной связью
(в нек-рых случаях с заметно полярным характером). Такие соед. образует большинство
непереходных металлов. Соед. переходных металлов этого типа стабильны только
при наличии в молекуле p-лигандов (СО, циклопентадиенил и др.). 2) М.с. с ионной
связью М—С. Такие соед., по существу,-металлич. соли карбанионов. Характерны
для щелочных и щел.-зем. металлов (за исключением Li и Mg), напр. Na+(C5H5)-,
K+(C-=CR) и др. 3) Электронодефицитные соед. с
мостиковыми двухэлект-ронными многоцентровыми связями М—С—М. К ним относят соед.
Li, Mg, Be, Al. 4) p-Комплексы-соед. металлов, содержащие p-связанные орг. лиганды
(алкены, алкины, ароматич. соед. и т.д.). М.с. этого типа характерны для переходных
металлов. Для непереходных металлов известны лишь отдельные примеры.
Известны полные М.с., в
к-рых атом металла связан только с атомами С, и смешанные, к-рые содержат также
связь металл - гетероатом.
Названия М.с. составляют
из названий орг. радикалов, металла и др. групп, присоединенных к металлу, напр.
тетраэтилсвинец [Рb(С2Н5)4], дибутилоловодихлорид
[SnCl2(C4H9)2]. В случае p-комплексов
для атомов С, участвующих в связывании с металлом, используют префикс h (см.
Гапто-); перед названиями мостиковых лигандов ставят префикс m, напр.
тетракарбонил(h-циклопентадие-нил)ванадий [V(CO)4(h-C5H5)],
дикарбонилметил(h-цикло-пентадиенил)железо [Fe(CH3)(CO)2(h-C5H5)]
(см. также Координационные соединения).
Соединения непереходных
металлов. Физ. св-ва этих соед. зависят от характера связи М—С. М.с. с ионной
связью обладают св-вами солей - высокими т-рами плавления, низкой летучестью,
плохой р-римостью в неполярных некоординирующих средах; М.с., содержащие такие
металлы, как Hg, Sn, Pb, S, обладают св-вами чисто орг. соед.-летучестью, р-римостью
в инертных орг. р-рителях, низкими т-рами плавления; низшие алкильные производные
металлов - перегоняющиеся жидкости, ароматич. М.с.-обычно твердые в-ва.
Хим. св-ва соед. определяются
полярностью связи Мd+ —Сd-. Группа, связанная с атомом
металла, носит карбанионный характер и подвергается атаке электроф. реагентами,
атом металла-нуклеоф. реагентами.
Полярность и реакц. способность
связи М—С для соед. металлов Пб и III гр. периодич. системы снижаются
с увеличением номера периода и возрастают для соед. металлов I, IIа, IV и V
групп.
Термич. устойчивость для
соед. металлов III и IV гр. уменьшается с увеличением номера периода, а также
при переходе к соед., образующим более стабильные карбанио-ны; напр., ароматические
М. с. более устойчивы, чем алифатические. С уменьшением полярности связи М—С
увеличивается склонность М. с. к гомолитич. распаду с образованием радикалов
и продуктов их превращений; напр., соед. Li, Mg, Al, содержащие в молекуле алкильные
группы, при нагр. разлагаются, давая алкен и гидрид металла, а соед. Hg, Pb
и др. выделяют металл и своб. радикалы.
Осн. хим. превращения соед.
непереходных металлов сопровождаются разрывом связи М—С. К ним относят: окисление,
гидролиз, р-ции с к-тами, галогенами и солями, присоединение по кратным связям,
диспропорционирова-ние, обмен анионоподобных остатков. Мн. соед. типа MRn
(R-алкил, арил) окисляются до оксида металла, СО2 и Н2О
и гидролизуются до М(ОН)n и RH. Соед. Li, Mg, Zn, Al чувствительны
к влаге и О2 воздуха, что обусловливает необходимость работы с ними
в атмосфере сухого инертного газа. Алкильные производные Li, Na, Be, Mg, Zn,
Al, Ca, In, Tl, Sb и Bi самовоспламеняются на воздухе. Соед. металлов I-III
гр. (кроме Hg и Тl) м. б. окислены в мягких условиях до пероксидов. Большинство
соед. металлов IV гр. и Hg слабо подвержены окислению.
Под действием минер. к-т,
галогенов, соед. с подвижным атомом водорода происходит деалкилирование (деарилиро-вание)
М.с. Процесс протекает ступенчато с образованием в конечном счете солей металлов.
Активные М.с. (Li, Mg и
др.) вступают в р-ции с орг. соед., содержащими функц. группы. Эти р-ции протекают
с разрывом связи М—С и широко используются в орг. синтезе. Для соед. металлов
II-IV гр. характерны р-ции перераспределения радикалов (см. Симметризация);
соед. щелочных и щел.-зем. металлов реагируют с СО2, давая соли
карбоновых к-т; соед. металлов I-III гр. образуют устойчивые комплексы с разл.
основаниями, к-рыми м. б. р-рители (эфиры, амины) и др. М.с., напр. MZnR3,
MAlR4 (М-щелочной металл). При отсутствии внеш. доноров электронов
могут образовываться самоассоциаты, напр. (LiCH3)4, [Al(CH3)3]2
и т.п.
Осн. способы получения.
1) Взаимод. металла с алкил- и арилгалогенидами (наиб. широко применяют для
получения литий- и магнийорг. соед.). Металлы со степенью окисления больше 1
образуют смешанные М. с. Использование сплавов металлов, напр. Hg, Sn или Pb
с Na или Mg, позволяет получить симметричные алкильные соед. Hg, Sn и Pb, что
используют в пром-сти (см. Металлирование). 2) Взаимод. литий- и магнийорг.
соед. с солями металлов. Этим методом получают полные и смешанные соед. практически
всех металлов, за исключением щелочных и щел.-зем. 3) Р-ции HgR2
с металлами; используют для получения индивидуальных М.с., обладающих высокой
реакц. способностью (Li, Mg и т.п.). 4) Диазометод (Несмеянова реакция)-взаимод.
порошка металла с двойными солями арилдиазония. Используют для получения ароматич.
соед. тяжелых непере-ходных металлов. 5) Присоединение гидридов Al, Sn и нек-рых
др. металлов к орг. соед., содержащим кратные связи углерод - углерод. 6) Взаимод.
углеводородов и нек-рых гетероциклич. соед., содержащих подвижный атом водорода,
с металлами и их солями. Используют для получения Na- и К-производных ацетилена,
циклопента-диена, индена, флуорена, арилалкенов, тиофена. Взаимод. ароматич.
и гетероароматич. соед. с солями Hg широко применяют для получения ртутьорг.
соединений.
Соединения переходных
металлов. Переходные металлы образуют соед. с обычной s-связью металл -
углерод, а также p-комплексы с орг. ненасыщ. молекулами. Разнообразие орг. лигандов
и способов их связывания с металлами определяет многочисленность этих соединений.
В соответствии с типом
орг. лиганда различают олефино-вые (алкеновые), ацетиленовые (алкиновые), аллильные,
диеновые (или полиеновые), циклопентадиенильные (включая металлоцены) и ареновые
комплексы переходных металлов. Нек-рые карборановые группировки также могут
вести себя как p-связанные лиганды. Существуют соед., содержащие одновременно
орг. лиганды разл. типов. Известны также би- и полиядерные М. с., к-рые могут
содержать связи металл - металл (см. Кластеры).
Переходные металлы способны
стабилизировать при координации неустойчивые орг. молекулы, ионы и своб. радикалы
(комплексы циклобутадиена, триметиленметана, карбенов, карбинов и т.п.).
С точки зрения теории мол.
орбиталей, в М. с. p-комплексного типа связи лигандов с металлом осуществляются
общей системой электронов. Эти делокализованные много-центровые связи могут
охватывать атом металла и часть или все углеродные атомы орг. лиганда. Определяющую
роль в связывании с металлом играют граничные p-орбита-ли лиганда. Сильное перекрывание
орбиталей металла и лиганда способствует образованию прочной связи. Это возможно,
когда энергии взаимодействующих орбиталей близки и орбитали имеют одинаковый
знак, т.е. одинаковые св-ва симметрии и фазу (см. Изолобальной аналогии принцип).
Распределение электронной
плотности между атомом металла и лигандом зависит от природы металла, степени
его окисления и от строения орг. лиганда. При этом изменения результирующих
зарядов на атоме металла и лиганде при образовании p-связи невелики, что обусловлено
особенностями связей металл -лиганд. Эти связи состоят из двух компонент: донорно-акцепторной
и дативной. Первая обусловлена подачей p-электронов лиганда на мол. орбитали
комплекса, образованные с участием d-орбиталей металла. Вторая включает
обратную подачу d-электронов металла на мол. орбитали, образованные за
счет перекрывания разрыхляющих (несвязывающих) p*-орбиталей лиганда и d-орбиталей
металла (см. рис.).
Стехиометрия многих, хотя
и не всех, p-комплексов подчиняется правилу эффективного атомного номера (ЭАН,
правило 18 электронов, правило инертного газа, правило Сиджвика). В соответствии
с этим правилом число валентных электронов у металла в комплексе (т. наз. ЭАН)
должно равняться числу
электронов в оболочке ближайшего к данному металлу инертного газа.
Правило определяет способность
атома металла наиб. полно использовать при образовании связи с лигандом свои
валентные орбитали nd, (n + 1)s и (п + 1)p, к-рые
суммарно м. б. заполнены 18 электронами. Для подсчета ЭАН к числу электронов
на внеш. оболочке атома (или иона) металла прибавляют число электронов, формально
передаваемых атому металла лигандами. Обычно принимают, что s-ал-кильные, s-арильные
лиганды и т. п. отдают атому металла один электрон, олефины - два, h3-аллил-три,
диены-четыре, h5-циклопентадиенил-пять и т.д. По этому принципу орг.
лиганды классифицируют на одно-, двух-, трехэлект-ронные и т. д. Атомы галогена
и водорода, а также группы CN, OR, SR формально передают один электрон, СО,
R3N, R3P-два, NO-три; связь металл - металл - по одному
электрону каждому атому металла. Если энергии орбиталей nd, (п + 1)s
и (п + 1)р близки, а орбитали доступны для связывания лигандов,
то выполняется правило ЭАН (напр., для комплексов V, Gr, Mn, Fe и Со в низших
степенях окисления). Отклонения от правила наблюдаются для комплексов металлов,
завершающих d-ряды, напр. Сu, Ag, Au, или при повышении степени окисления
металла, т. е. в тех случаях, когда увеличивается энергетическая щель между
d- и дальними s- и р-орбиталями. Тем не менее правило ЭАН
помогает установить формулы новых соединений.
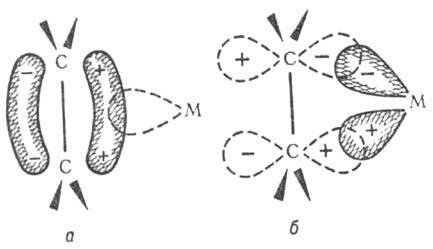
Образование связи металл
- олефин: а) смещение электронов с заполненной p-орбитали олефина на
вакантную орбиталь атома металла (донорно-акцепторная связь); о) обратное донорное
взаимод. заполненной орбитали атома металла с вакантной
p*-орбиталью олефина (дативная связь).
М.с., гл. обр. переходных
металлов и нек-рых непереходных, напр. комплексы аллена, циклополиенов, аллильные
и карбонильные комплексы, претерпевают быстрые внутри-мол. перегруппировки,
к-рые заключаются в стереохим. превращениях или в обмене подобных групп. Такое
явление наз. стереохим. нежесткостью, а молекулы-стереохими-чески нежесткими.
К числу последних также относят флуктуирующие молекулы, к-рые после любого числа
миграций остаются химически идентичными и различаются лишь взаимным положением
химически неразличимых ядер, напр.:
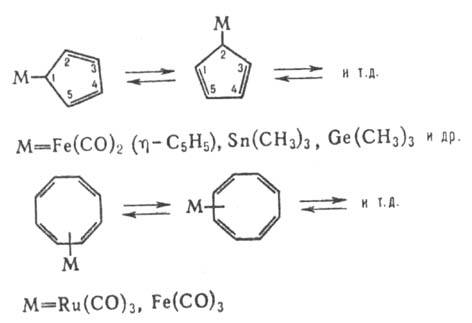
Осн. метод обнаружения
и изучения стереохим. нежесткости-спектроскопия ЯМР.
Хим. св-ва я-комплексных
М.с. зависят гл. обр. от природы лигандов и в меньшей степени-от природы центр.
атомов металла. Р-ции этих М. с. возможны как с частичным или полным сохранением
связи металл-лиганд (хим. модификация орг. лиганда, замещение, присоединение
или отщепление др. групп), так и с ее разрывом. Р-ции обмена лигандов указывают
на сходство этих соед. с неорг. координационными соед., др. р-ции, напр. электроф.
замещения, делают их формальными аналогами ароматич. соединений. Ароматич. характер
проявляют, как правило, комплексы, содержащие циклич. непредельные лиганды,
металлоце-ны (прежде всего, ферроцен), циклобутадиеновые, напр. [Fe(CO)3(h-C4H4)],
и циклооктатетраеновые комплексы, напр. [U(h-C8H8)2]
или [Fe(CO)3(h4-C8H8)]. При образовании
связи с металлом существенно меняются св-ва орг. дигандов. В зависимости от
природы металла, а также природы и числа др. лигандов, орг. лиганды могут проявлять
св-ва карбанионов, карбкатионов, карбенов или своб. радикалов. Так, непредельные
углеводородные лиганды в p-комплексах (особенно катионных) способны реагировать
с нуклеоф. реагентами.
Осн. хим. превращения и
методы получения М.с. переходных металлов описаны в статьях по отдельным типам
комплексов (см. Ацетиленовые комплексы переходных металлов и т.д.) и
соед. конкретных металлов (см. Железо-органические соединения, Палладипорганические
соединения и т.д.).
Из разнообразных методов
получения соед. переходных металлов выделяют две осн. группы. К первой относят
р-ции, при к-рых происходит образование М.с. из солей или карбонилов металлов
при действии на них орг. или ме-таллоорг. реагентов; при этом орг. лиганд присоединяется
к атому металла, замещая частично или полностью др. группы, содержащиеся в исходном
соединении. Вторая группа методов объединяет превращения одних М.с. в другие;
в таких р-циях могут происходить изменения в координац. сфере металла, а также
внутримол. перегруппировки. Так, известны взаимные переходы между h2-олефиновыми
комплексами и соед. с s-связью М—С, между h3-аллильными комплексами
и h4-диеновыми (или h2-олефиновыми), h6-ареновыми
и h5 -циклогексадиенильными и т.д.
М.с. применяют в качестве
катализаторов и полупродуктов во мн. промышленно важных процессах, напр. при
гомог. жидкофазном гидрировании олефинов и ацетиленов (Rh, Ru, Co), а также
их димеризации и олигомеризации (Со, Ni, Cu, Rh, Pd), в р-ции перераспределения
(метатезиса) олефинов (W, Mo, Re), в многочисл. р-циях с участием СО, таких,
как гидроформилирование и карбонилирование (Fe, Со, Ni, Rh, Pd), при получении
СН3СНО и винилацетата окислением этилена (Pd), при асимметрич. гидрировании
и изомеризации (хиральные фосфинродиевые кат.) (см. Ме-таллокомплексный катализ).
М.с.-исходные в-ва при
получении чистых металлов, металлич. пленок и покрытий, стабилизаторов полимеров,
антидетонаторов. М.с. используют также в качестве антисептиков (Sn), присадок
к смазочным маслам (Sn, Pb), они обладают св-вами фунгицидов и дезинфектантов
(Hg).
Мн. М.с. токсичны (алкильные
соед. Hg, Sn, Pb, карбо-нилы Ni, Fe).
М. с. сыграли важную роль
в установлении представлений о валентности, хим. эквиваленте, атомной массе,
хим. связи.
===
Исп. литература для статьи «МЕТАЛЛООРГАНИЧЕСКИЕ»: Методы элементоорганической
химии, под общ. ред. А. Н. Несмеянова и К.А. Кочешкова, М., 1963-1978; Коттон
Ф., Уилкинсон Дж., Основы неорганической химии, пер. с англ., М., 1979, с. 550-636;
Общая органическая химия, пер. с англ., т. 7, М., 1984; Металлоорганическая
химия переходных металлов. Основы и применения, пер. с англ., ч. 1-2, М., 1989;
Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 1-9. Oxf., 1982.
Л. В. Рыбин, А. С. Перегудов.
Страница «МЕТАЛЛООРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
|

