|
рН-МEТРИЯ,
совокупность потенциометрич. методов определения водородного показателя
рН. Они основаны на измерении эдс гальванич. элемента, состоящего из индикаторного
электрода, обратимо реагирующего на изменение активности % ионов водорода, и
электрода сравнения (насыщенного каломельного или хлорсеребряного). Последний
обычно погружают в р-р электролита, к-рый соединен с исследуемым р-ром солевым
мостиком-трубкой, заполненной насыщ. р-ром КСl.
Индикаторным может служить
водородный электрод, к-рый представляет собой покрытую платиновой чернью платиновую
пластинку, погруженную в р-р к-ты, насыщенный газообразным водородом. При парциальном
давлении водорода рH2 = 1 атм (101,3 кПа) и активности
ионов Н3О+ aHзO+ = 1 потенциал этого
электрода принят за нуль при любой т-ре (стандартный водородный электрод). В
соответствии с ур-нием Н+ + е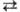 1/2Н2
потенциал водородного электрода E=- 0,0591рН (В) при 25°С. Водородный
электрод пригоден для определения рН в интервале от 0 до 14. Для практич. работы
он не удобен из-за относительно сложной конструкции, довольно быстрого отравления
платины, необходимости получения электролитически чистого Н2 и невозможности
измерения рН в присут. окислителей, восстановителей и ионов тяжелых металлов.
Поэтому обычно применяют др. электроды, обратимые относительно ионов Н+
,-сурьмяный, хингидрон-ный и стеклянный, потенциалы к-рых отсчитывают от потенциала
стандартного водородного электрода (водородная шкала потенциалов). 1/2Н2
потенциал водородного электрода E=- 0,0591рН (В) при 25°С. Водородный
электрод пригоден для определения рН в интервале от 0 до 14. Для практич. работы
он не удобен из-за относительно сложной конструкции, довольно быстрого отравления
платины, необходимости получения электролитически чистого Н2 и невозможности
измерения рН в присут. окислителей, восстановителей и ионов тяжелых металлов.
Поэтому обычно применяют др. электроды, обратимые относительно ионов Н+
,-сурьмяный, хингидрон-ный и стеклянный, потенциалы к-рых отсчитывают от потенциала
стандартного водородного электрода (водородная шкала потенциалов).
Сурьмяный электрод изготавливают
из чистой метал-лич. Sb. Согласно ур-нию Sb2O3 + 6Н+
+ 6е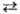 2Sb
+ ЗН2О, потенциал сурьмяного электрода Е = Е' + (RT/F)lnан+
, где Е'- экспериментально определяемая константа, R -газовая
постоянная, Т-абс. т-ра, F- число Фарадея. Показания прибора с
использованием этого электрода стабильны, погрешности измерений не превышают
b0,2 рН в интервале рН 3-10; электрод пригоден для измерения рН в отсутствие
окислителей, H2S и ионов тяжелых металлов; при этом необходимо контролировать
т-ру р-ра. 2Sb
+ ЗН2О, потенциал сурьмяного электрода Е = Е' + (RT/F)lnан+
, где Е'- экспериментально определяемая константа, R -газовая
постоянная, Т-абс. т-ра, F- число Фарадея. Показания прибора с
использованием этого электрода стабильны, погрешности измерений не превышают
b0,2 рН в интервале рН 3-10; электрод пригоден для измерения рН в отсутствие
окислителей, H2S и ионов тяжелых металлов; при этом необходимо контролировать
т-ру р-ра.
Х и н г и д р о н н ы й
э л е к т р о д представляет собой гладкий платиновый электрод, погруженный
в исследуемый р-р, насыщенный хингидроном - молекулярным комплексом 1:1 хинона
(Q) и гидрохинона (H2Q). В соответствии с ур-нием Q + 2Н+
+ 2е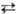 H2Q
потенциал электрода Е = E0Q/H2Q + + (RT/2F)ln(aQa2H+/aH2Q).
Так как (aQ/aH2Q) = 1, то E = = E0Q/H2Q
+ (RT/F)lnaH+ . Последнее ур-ние справедливо в интервале
рН 1-8; при рН > 8 отношение aQ/aH2Q
не является постоянной величиной вследствие окисления хинона растворенным О2.
Хингидронным электродом нельзя пользоваться в щелочной среде, в присут. окислителей,
восстановителей, аминов, NH3 и солей аммония. Достоинство этого электрода-низкое
электрич. сопротивление, что позволяет применять для измерения рН простую электрич.
схему (см. рис. в ст. Потенциометрия). H2Q
потенциал электрода Е = E0Q/H2Q + + (RT/2F)ln(aQa2H+/aH2Q).
Так как (aQ/aH2Q) = 1, то E = = E0Q/H2Q
+ (RT/F)lnaH+ . Последнее ур-ние справедливо в интервале
рН 1-8; при рН > 8 отношение aQ/aH2Q
не является постоянной величиной вследствие окисления хинона растворенным О2.
Хингидронным электродом нельзя пользоваться в щелочной среде, в присут. окислителей,
восстановителей, аминов, NH3 и солей аммония. Достоинство этого электрода-низкое
электрич. сопротивление, что позволяет применять для измерения рН простую электрич.
схему (см. рис. в ст. Потенциометрия).
Наиб. распространен стеклянный
электрод, к-рый представляет собой тонкостенный шарик из стекла спец. состава
(напр., 72% SiO2, 8% СаО, 20% Na2O), припаянный к стеклянной
трубке. Внутрь шарика наливают 0,1 М р-р НСl и погружают в него хлорсеребряный
электрод (серебряная проволока в насыщ. р-ре AgCl)- внутр. электрод сравнения.
Чувствительной к ионам Н+ является только стеклянная мембрана на
кончике электрода, к-рую предварительно хорошо вымачивают в 0,1 М р-ре НСl.
Потенциал стеклянного электрода определяется ур-нием Е = const + + 0,0591
lgaH+ в широком интервале рН, протяженность к-рого
зависит от сорта стекла. Состав стекла, применяемого для изготовления мембраны,
влияет на величину константы равновесия (КH-M) обмена между
ионами Н+ в слое гидратированного геля на пов-сти мембраны и ионами
щелочных металлов в р-ре. Большинство электродов не способны различать ионы
Н+ и ионы Na+, K+, Li+ при рН >
11, но есть электроды, дающие правильные результаты вплоть до рН 14. Недостаток
стеклянного электрода-нестабильность во времени т.наз. потенциала асимметрии
(входит в величину const), обусловленного неравноценностью внеш. и внутр. пов-сти
стеклянной мембраны. Поэтому необходимо периодически градуировать электрод по
буферным р-рам с известным рН (см. ниже). Потенциал стеклянного электрода устанавливается
очень быстро, погрешность измерения рН в интервале 2-10 составляет b0,05
рН. Не мешают растворенные газы, окислители, восстановители, белки. Мешают дегидратирующие
в-ва, концент-рир. р-ры щелочей и к-т. Неправильные результаты получаются в
р-рах с низкой буферной емкостью, напр. в воде. Стеклянный электрод пригоден
для измерения рН не только р-ров, но и эмульсий, суспензий, паст. В зависимости
от назначения его размеры варьируют в широких пределах. Есть электроды, позволяющие
измерять рН весьма малых объемов (~0,02 мл).
Стеклянный электрод обладает
высоким электрич. сопротивлением (107-108 Ом), поэтому
для измерения его потенциала необходим спец. прибор -рН-метр, к-рый представляет
собой электронный вольтметр с высоким входным сопротивлением или потенциометр
с электронным усилителем (вместо гальванометра). В последнем случае усиленный
на неск. порядков ток в цепи с исследуемым элементом можно детектировать грубым
миллиамперметром.
Для измерения рН стеклянный
электрод и электрод сравнения (каломельный) погружают сначала в буферный р-р
с известным рНст (т.наз. рН-стандарт) и настраивают рН-метр на величину
рН этого р-ра. Затем электроды промывают и переносят в исследуемый р-р с рНx;
при этом рНх = рНст + [(Еx - Eст)F/2,303RT],
где Ех и Eст-соответ-ствующие потенциалы
стеклянного электрода. Для удобства шкалу рН-метра градуируют в единицах рН
и снабжают спец. устройством для контроля т-ры р-ра (чтобы регулировать величину
2,303RT).
Для градуирования стеклянного
электрода в качестве рН-стандартов рекомендованы: насыщ. р-р тартрата К, 0,05
М р-р бифталата К, смесь 0,05 М р-ра КН2РО4 и 0,025 М
р-ра Na2HPO4, смесь 0,008695 М р-ра КН2РО3
и 0,03043 М р-ра Na2HPO4, 0,01 М р-р Na2B4O7.
При 25 °С величины рН этих р-ров равны 3,56; 4,01; 6,87; 7,41; 9,18 соответственно.
Причем рН будет иметь одно и то же значение независимо от того, какой из рН-стандартов
был взят при градуировке электрода.
Хотя измеренные рН-метром
значения рН равны — lgaHзO+ только для очень разбавленных
водных р-ров, тем не менее эти величины служат полезной характеристикой кислотности
р-ров, в т.ч. и неводных. При замене воды неводным р-рителем увеличивается электрич.
сопротивление р-ра, становится менее воспроизводимым потенциал электрода, поэтому
рекомендуется рассматривать каждый р-ри-тель как независимую систему с собственной
шкалой кислотности, протяженность к-рой определяется величиной константы автопротолиза
р-рителя.
рН-Метрию применяют для
контроля разл. технол. процессов, в лаб. исследованиях и т.д.
===
Исп. литература для статьи «рН-МEТРИЯ»: Бейтс Р.,
Определение рН. Теория и практика, пер. с англ., Л., 1968; Никольский Б. М.,
Матерова Е. А., Ионоселективные электроды, Л., 1980, с. 114; Мейтис Л., Введение
в курс химического равновесия и кинетики, пер. с англ., М., 1984, с. 365. Г.
В. Прохорова.
Страница «рН-МEТРИЯ» подготовлена по материалам химической энциклопедии.
|

