|
МОДИФИКАЦИЯ БЕЛКОВ (от
позднелат. modificatio-изменение) биогенная, происходит после завершения трансляции
матричной рибонуклеиновой к-ты, или мРНК, (синтез белка на мРНК-матрице)
или до ее завершения. В первом случае М.б. наз. п о с т т р а н с л я ц и о
н н о й, во втором
-к o т р а н c л я ц и о н н о й. Осуществляется благодаря
р-циям разл. функц. групп аминокислотных остатков, а также пептидных связей
и обусловливает конечную форму белковой молекулы, ее физиол. активность, стабильность,
перемещения внутри клетки.
Внеклеточные (секретируемые)
белки, а также мн. белки цитоплазматич. мембраны и разл. внутриклеточных ком-партментов
(обособленных участков клетки) подвергаются гликозилированию, в результате к-рого
образуются глико-протеины. Наиб. сложно организованы маннозосодержащие
цепи, присоединенные к полипептидам N-гликозидной связью. Начальная стадия формирования
таких цепей протекает котрансляционно по схеме:
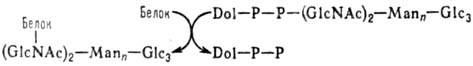
Dol-долихол (полипренол),
Dol—Р—Р-долихолпирофосфат, Glc-глюкоза, GlсNАс-N-ацетил-D-глюкозамин, Маn-манноза
Послед. стадии осуществляются
посттрансляционно с участием неск. ферментов, локализованных в разных субклеточных
компартментах. Так, для G-белка вируса везикулярного стоматита, гликозидные
цепи к-рого построены из 15 углеводных остатков, установлена такая последовательность
событий. Сначала в эндоплазматич. ретикулуме происходит в две стадии отделение
терминальных остатков глюкозы с участием двух разных глюкозидаз. Затем ман-нозидазы
(I и II) удаляют 6 остатков маннозы, а N-ацетил-D-глюкозаминтрансфераза осуществляет
присоединение трех остатков GlcNAc к остаткам маннозы гликопротеина. Наконец,
в комплексе Гольджи с этими остатками связываются с участием соответствующих
трансфераз остатки фукозы, галактозы и сиаловой к-ты. Моносахаридные остатки
могут подвергаться фосфорилированию, сульфированию и др. модификациям.
Гликозилированию секретируемых
белков предшествует протеолитич. процессинг - отделение от N-конца поли-пептидной
цепи "сигнальной" последовательности аминокислот. В эукариотич.
клетках (клетки всех организмов, за исключением бактерий и синезеленых водорослей)
этот процесс осуществляется контрансляционно, в прокариотич. клетках (клетки
бактерий и синезеленых водорослей) он может протекать посттрансляционно. Наиб.
распространенные сигнальные последовательности включают 23 аминокислотных остатка.
Характерные особенности этих последовательностей -наличие на конце короткого
положительно заряженного участка, за к-рым следует гидрофобный участок, содержащий
от 7 до 14 аминокислотных остатков. Сигнальные последовательности завершаются
консервативным по длине (5-7 остатков) гидрофильным участком, на С-конце к-рого
чаще всего находятся остатки аланина, глицина, серина, треонина, цистeина или
глутамина.
Почти все функцион. классы
внеклеточных белков (ферменты, гормоны, иммуноглобулины и др.) содержат ди-сульфидные
связи. Они образуются из групп SH цистенна в ходе многостадийного процесса с
участием фермента ди-сульфидизомеразы. На его ранних стадиях появляется значит.
кол-во "неправильных" дисульфидных мостиков, к-рые ликвидируются
в результате тиол-дисульфидного обмена, в к-ром, по-видимому, участвует цистамин
(H2NCH2CH2S)2. Предполагают, что
такой "перебор" связей происходит до тех пор, пока не возникает
наиб. стабильная третичная структура, в к-рой дисульфидные мостики "захоронены"
и вследствие этого недоступны реагентам.
К наиб. распространенным
модификациям внутриклеточных белков относятся фосфорилированис и дефосфорилиро-вание
по группе ОН остатков серина, тирозина и треонина, к-рые осуществляются с участием
ферментов протеинкиназ и фосфатаз по схеме:
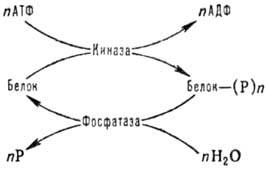
АТФ - аденозинтрифосфат,
АДФ - аденозиндифосфат, Р -фосфорная к-та или ее остаток
Фосфорилирование сопровождается
активацией или инактивацией ферментов, напр. гликозилтрансфераз, а также изменением
физ.-хим. св-в неферментных белков. Обратимое фосфорилирование белков контролирует,
напр., такие важные процессы, как транскрипция и трансляция, метаболизм липидов,
глюконеогенез, мышечное сокращение.
Белки митохондрий и хлоропластов,
кодируемые ядерными ДНК, имеют на N-конце избыточные аминокислотные последовательности,
к-рые избирательно направляют полипептидные
цепи в определенные компартменты органелл, после чего отщепляются в результате
протеолиза с участием специфич. эндопептидаз. Избыточные последовательности
предшественников митохондриальных белков существенно различаются по кол-ву аминокислотных
остатков; их может быть от 22 до 80. Короткие последовательности характеризуются
высоким (20-25%) содержанием положительно заряженных аминокислотных остатков,
равномерно расположенных по полипептидной цепи. Длинные последовательности включают
дополнительно участок, состоящий из гидрофобных аминокислот, к-рый "заякоревает"
предшественник в липидном бислое митохондриальных мембран.
Известны предшественники
для ряда гормонов (напр., для гастрина, глюкагона и инсулина), к-рые переходят
в активную форму посредством расщепления полипептидной цепи в участках, содержащих
два последовательно расположенных остатка основных аминокислот (аргинин и лизин).
Расщепление осуществляется с участием специфич. эндопептидазы, действующей в
ансамбле со вторым ферментом, имеющим карбоксипептидазную активность. Последний
удаляет остатки концевых основных аминокислот, завершая превращ. пептида в активный
гормон. К белкам, подвергающимся протеолитич. активации, относятся также протеиназы
(пепсин, трипсин, химотрипсин), альбумины, проколлаген, белки системы свертывания
крови и др. В нек-рых случаях неактивные формы ферментов (зимогены) необходимы
для временной "консервации" ферментов. Так, зимогены трипсина и
химотрипсина (соотв. трипсиноген и химотрипсиноген) синтезируются в поджелудочной
железе, секретируются в тонкий кишечник и только там под действием специфич.
ферментов превращ. в активную форму.
Широкий круг белков (гистоны,
миозин, актин, рибо-сомальные белки и др.) метилируются посттрансляционно по
остаткам лизина, аргинина и гистидина (N-метилирова-ние), а также по остаткам
глутаминовой и аспарагиновой к-т (О-метилирование). В качестве метилирующего
агента обычно выступает S-аденозилметионин.
В нек-рых эукариотич. клетках
более половины р-римых белков ацетилированы по N-концу. Этот процесс может осуществляться
ко- и посттрансляционно (на схеме обозначено соотв. К. Т. и П. Т.), напр.:
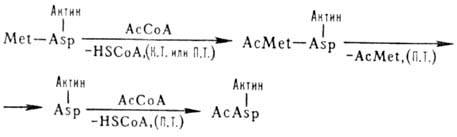
HSCoA-кофермент А, АсСоА
- ацетилкофермент A, Met-метионин, Asp - аспарагиновая к-та
Для пептидов, содержащих
от 3 до 64 аминокислотных остатков и секретируемых в разл. органы(гастрин, секретин,
холецистокинин и др.), обнаружено посттрансляц. амидиро-вание остатка С-концевой
аминокислоты (за исключением концевых остатков аргинина и аспарагина).
Нек-рые типы модификаций
характерны для отдельных белков или небольших групп белков. В частности, в коллагене
и неск. др. белках со сходными аминокислотными последовательностями обнаружены
4- и 3-гидроксипролин, а также 5-гидроксилизин. Гидроксилирование остатков про-лина
и лизина протекает котрансляционно и имеет важное значение для формирования
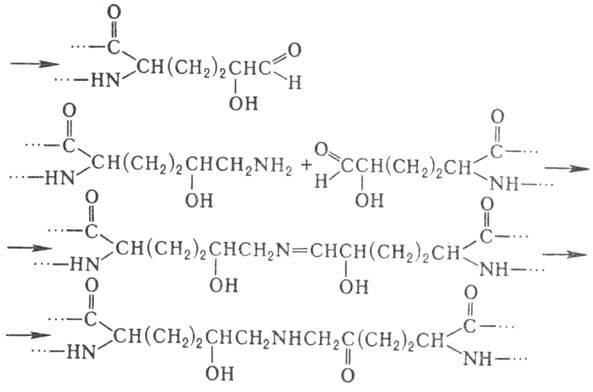
уникальной структуры коллагена. Гидроксилизин участвует в образовании ковалент-ных
сшивок между полипептидными цепями коллагена по схеме:
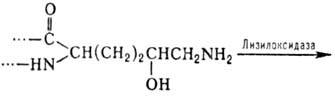
Ядерные белки (гистоны,
негистоновые белки) подвергаются аденозиндифосфатрибозилированию и полиаденозин-дифосфатрибозилированию,
в ходе к-рого аденозиндифос-фатрибозильные остатки переносятся от кофермента
ни-котинамидадениндинуклеотида (НАД) к акцепторным белкам:
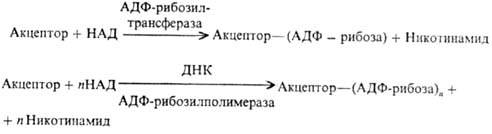
Эти две р-ции различны
во мн. аспектах. В частности, полиаденозиндифосфатрибозилирование протекает
в при-сут. ДНК. Большинство аденозиндифосфатрибозильных групп присоединяется
к белкам посредством эфирной связи, образованной группой ОН в положении 5' остатка
рибозы и группой СООН С-концевой аминокислоты или глутаминовой к-ты, находящейся
внутри полипептидной цепи.
Большое значение имеет
карбоксилирование остатков глутаминовой к-ты с образованием g-карбоксиглутаминовой
к-ты в предшественнике протромбина. Эта р-ция катализируется витамин К-зависимой
карбоксилазой, локализованной в мембранах эндоплазматич. ретикулума. Аналогичная
р-ция протекает при созревании нек-рых др. факторов свертывания крови.
===
Исп. литература для статьи «МОДИФИКАЦИЯ БЕЛКОВ»: Основы биохимии,
пер. с англ., т. 1, М., 1981, с. 277-80; Общая органическая химия, пер. с англ.,
т. 10, М., 1986, с. 543-70; The enzymology of post-translational modification
of proteins, v. 1, L.-N. Y., 1980; The biochemistry of glycpproteins and proteoglycans,
N. Y.-L., 1980; Cell biology. A comprehensive treatise, v. 4-Translation and
the behavior of proteins, N. Y., 1980; Methods in enzymology, v. 106, N.Y.,
1984; Hurt E.G., Loon A.P.G.M. van, "Trends in Biochem. Sci.", 1986,
v. 11, № 5. n. 204-07. В. Н. Лузиков.
Страница «МОДИФИКАЦИЯ БЕЛКОВ» подготовлена по материалам химической энциклопедии.
|

