|
МОЛОЧНАЯ КИСЛОТА (2-гидроксипропионовая
к-та) СН3СН(ОН)СООН, мол. м. 90,1; бесцв. кристаллы. Известны Д(+)-молочная
к-та, D( —)-молочная (мясо-молочная) к-та и рацемич. М.к.-молочная к-та брожения.
Для D,L- и D-М.к. т.пл. соотв. 18 °С и 53 °С; т. кип. соотв. 85°С/1
мм рт.ст. и 103°С/2мм рт.ст.; для D-М.к. [a]D20
-2,26 (концентрация 1,24% в воде). Для D,L-M. к. DH0обр
- 682,45 кДж/моль; DH0пл 11,35 кДж/моль;
DHисп 110,95 кДж/моль
(25°С), 65,73 кДж/моль (150°С). Для L-М.к. DH0сгор
- 1344,8 кДж/моль; DH0обp -694,54 кДж/моль; DH0пл
16,87 кДж/моль.
Из-за высокой гигроскопичности
М.к. обычно используют ее концентрир. водные р-ры-сиропообразные бесцв. жидкости
без запаха. Для водных р-ров М.к. d204 1,0959 (40%),
1,1883 (80%), 1,2246 (100%); nD25 1,3718 (37,3%),
1,4244 (88,6%); h 3,09 и 28,5 мПа.с (25 0С) соотв. для
45,48 и 85,32%-ных р-ров; g 46,0.10-3 Н/м(25°С)для
1 М р-ра; е 22 (17°С). М.к. раств. в воде, этаноле, плохо-в бензоле, хлороформе
и др. галогенуглеводородах; рKа 3,862 (25 °С); рН водных
р-ров 1,23 (37,3%), 0,2 (84,0%).
Окисление М.к. обычно сопровождается
разложением. При действии HNO3 или О2 воздуха в присут.
Сu или Fe образуются НСООН, СН3СООН, (СООН)2, СН3СНО,
СО2 и пировиноградная к-та. Восстановление М.к. HI приводит к пропионовой
к-те, а восстановление в присут. Re-черни - к пропиленгликолю.
М. к. дегидратируется до
акриловой к-ты, при нагр. с НВr образует 2-бромпропионовую к-ту, при взаимод.
Са-соли с РСl5 или SОСl2-2-хлорпропионилхлорид. В присут.
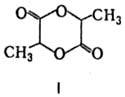
минер. к-т происходит самоэтерификация М.к. с образованием лактона ф-лы I, а
также линейных полиэфиров. При взаимод. М.к. со спиртами образуются гидроксикислоты
RCH2CH(OH)COOH, a при взаимод. солей М.к. со спиртамиэфиры.
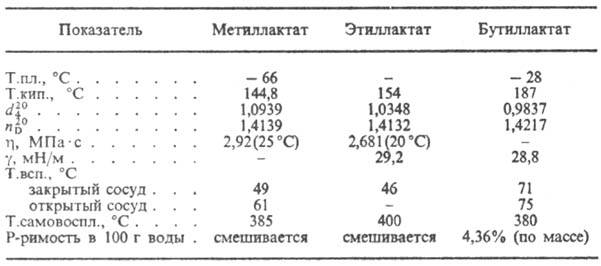
Соли и эфиры М. к. наз. лактатами (см. табл.).
М.к. образуется в результате
молочнокислого брожения
(при скисании молока, квашении капусты, солении овощей, созревании
сыра, силосовании кормов); D-М.к. обнаружена в
тканях животных, растений, а также в микроорганизмах.
В пром-сти М. к. получают
гидролизом 2-хлорпропионовой к-ты и ее солей (100 °С) или лактонитрила CH3CH(OH)CN
(100 °С, H2SO4) с послед. образованием эфиров, выделение
и гидролиз к-рых приводит к продукту высокого качества. Известны др. способы
получения М.к.: окисление пропилена оксидами азота (15-20°С) с послед. обработкой
H2SO4, взаимод. СН3СНО с СО (200 °С, 20
МПа).
СВОЙСТВА НЕКОТОРЫХ ЛАКТАТОВ
М.к. применяют в пищ. пром-сти,
в протравном крашении, в кожевенном произ-ве, в бродильных цехах в качестве
бактерицидного ср-ва, для получения лек. ср-в, пластификаторов. Этил- и бутиллактаты
применяют в качестве р-рителей эфиров целлюлозы, олиф, растит. масел; бутил-лактат-также
как р-ритель нек-рых синтетич. полимеров.
Мировое произ-во М.к. 40
тыс. т (1983).
===
Исп. литература для статьи «МОЛОЧНАЯ КИСЛОТА»: HoltenC.H.,
Lactic acid. Properties and chemistry. Lactic acid and derivatives, Weisheim,
1971. Ю. А. Трeгер.
Страница «МОЛОЧНАЯ КИСЛОТА» подготовлена по материалам химической энциклопедии.
|

