|
МЫШЬЯКА
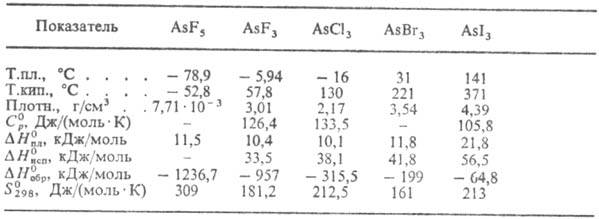
ГАЛОГЕНИДЫ. П е н т а ф т о р и д AsFs-бесцв. газ (см. табл.);
ур-ние температурной зависимости давления пара над жидким AsFs: lgp
(мм рт.ст.) = 7,845 — — 1093,7/Т (193-220 К); раств. в воде и р-рах щелочей
(с большим выделением тепла), в диэтиловом эфире, этаноле и бензоле. С сухим
стеклом на холоду не реагирует, в присут. влаги легко его разъедает. Обугливает
бумагу и сахар. При нагр. реагирует с Сu, Zn, Fe, особенно легко-с Рb и Hg.
Взаимод. при нагр. с фторидами щелочных металлов с образованием р-римых в воде
гексафторарсенатов(V) M[AsF6]; из р-ров выделен также K2[AsF7].H2O.
С фторидами Сu, Zn, Fe и др. образует соед. M[AsF7]. Получают AsF5
фторированием As. Используют как катализатор полимеризации, а также для синтеза
Li[AsF6] (компонент электролитов источников тока).
СВОЙСТВА ГАЛОГЕНИДОВ
МЫШЬЯКА
П е н т а х л о р и д AsCl5;
т.шт. — 40 °С, очень нестоек, даже при — 50 °С разлагается за неск.
мин; получается при УФ облучении р-ра AsCl3 в жидком Сl2.
Описаны нек-рые хлорпроизводные As(V). О к с и х л о р и д AsOCl3,
образующийся при действии О3 на AsCl3 при низких т-рах,
также малоустойчив, но продукт его разложения As2O3Cl4
устойчив до 150°С. Получены нек-рые двойные хлориды As(V), напр. SbAsCl10
и GaAsCl8, содержащие катион [AsCl4] + тетраэдрич.
строения.
Все тригалогениды As в
парах мономерны. Их молекулы имеют строение тригон. пирамиды с атомом As в вершине.
При их окислении (или взаимод. с As2O3) образуются малоустойчивые
оксигалогениды AsOX. Гидратированные оксигалогениды получают при неполном гидролизе
три-галогенидов As.
Т р и ф т о р и д AsF3-6ecцв.,
подвижная, дымящая на воздухе жидкость; ур-ние температурной зависимости давления
пара над жидким AsF3: lgp (мм рт.ст.) = 61,38 - 4150/T--
18,26 lg T; раств. в воде (с разл.), этаноле, диэтиловом эфире, бензоле.
При нагр. реагирует с обычным и кварцевым стеклами. Присоединяет бром и иод,
NH3. Энергично реагирует на холоду с хлоридами Si, P, S. С фторидами
щелочных металлов образует фторарсенаты(III) M[AsF4], с SbF3-соед.
[AsF2]+ [SbF4]-. Получают AsF3
действием H2SO4 на смесь As2O3 с
CaF2, нагреванием As2O3 с KHF2.
Применяют как катализатор полимеризации.
При действии Сl2
на AsF3 образуется димерный дихло-ротрифторид As, имеющий строение
[AsCl4]+ [AsF6] ; т.пл. 160°С (с разл.).
При его нагревании в вакууме получают мономерный AsCl2F3
с т.пл. - 75 °С, а также др. малоустойчивые хлорофториды As(V).
Т р и х л о р и д АsСl3-бесцв.
маслянистая жидкость, дымящая на воздухе, при застывании образует кристаллы
с перламутровым блеском; ур-ние температурной зависимости давления пара: lgp
(мм рт.ст.) = 7,953 — 2043/Т (323-373 К); раств. в воде (53% по массе),
в разб. р-рах гидро-лизуется с образованием мышьяковистой к-ты; раств. в соляной
к-те, с ростом концентрации НСl р-римость AsCl3 уменьшается (р-римость
в 11 М НСl 200 г/л), падает также и степень гидролиза. Трихлорид отгоняется
из солянокислого р-ра. При пропускании Сl2, а также добавлении др.
окислителей в р-р AsCl3 в соляной к-те As(III) окисляется до As(V).
С большинством орг. р-рителей
AsCl3 смешивается во всех отношениях с образованием продуктов присоединения.
Хорошо растворяет S, P, хлориды мн. металлов. С хлоридами одновалентных металлов
образует хлорарсенаты(III) M[AsCl4], с хлоридами Rb и Cs-M3[As2Cl9],
с NH3-AsCl3-4NH3. Пары AsCl3 восстанавливаются
Н2 до As. Трихлорид восстанавливается также щелочными металлами,
Mg, Zn, Al при нагр., реагирует с Сu, Ni, Sn, Pb и др. металлами.
Получают AsCl3
действием Сl2 на As или газообразного HCI на As2O3
при 180-200 °С, в пром-сти - хлорированием As2O3 в
расплаве S. Очищают ректификацией, адсорбцией, экстракцией, термич. обработкой
и т.д. Используют для получения As высокой чистоты, полупроводниковых соед.
As, в произ-ве мед. препаратов, для получения др. соед. As.
Очень токсичен, обладает
сильным кожно-нарывным действием; ЛД50 2,5 мг/л (белые мыши, 10 мин),
0,1 мг/л (кошки, 60 мин), ПДК 0,2 мг/л (< 1 мин).
Б р о м и д АsВr3-бесцв.
кристаллы ромбич. сингонии (а = 1,051 нм, b = 1,207 нм, с =
0,431 нм, z = 4, пространств. группа P212121).
Гигроскопичен, расплывается на воздухе. Раств. в воде (с разл.), диэтиловом
эфире, бензоле, CS2. Получают взакмод. Вr2 с As, Вr2
со смесью As2O3 и S.
Т р и и о д и д AsI 3-
оранжево-красные или рубиново-крас-ные кристаллы гексагoн. сингонии (а= 0,721
нм, с = = 0,2145 нм, z = 6, пространств. группа R3).
В расплавленном состоянии коричнево-красный; ур-ние температурной зависимости
давления пара: lgp(MM рт.ст.) = 30,148 —
4897/T+ 7,0 lg T; при хранении на воздухе постепенно окисляется;
раств. в воде (с разл.), этаноле, диэтиловом эфире, бензоле, ксилоле, CS2.
С иодидами К, Rb и Cs образует иодарсенаты(III) M3[As2I9].
Получают действием р-ра I2 в диэтиловом эфире или CS2
на As, осаждением KI из солянокислого р-ра AsCl3. Используют для
синтеза полупроводниковых соед. As.
Д и и о д и д (тетраиодид
димышьяка) As2I4-красные кристаллы; т.пл. 137°С, т.кип.
~375°С, уже при ~230°С начинает разлагаться на AsI3 и As;
на воздухе быстро окисляется, при действии воды диспропорционирует с выделением
As; раств. в CS2, бензоле с частичным диспро-порционированием; получают
сплавлением AsI3 с As в инертной атмосфере или синтезом из элементов
в р-ре октагидрофенантрена.
При сплавлении тригалогенидов
с халькогенидами As получают х а л ь к о г е н г а л о г е н и д ы в осн. типа
АзЭХ.
Это красно-коричневые или
черные в-ва, в большинстве легко образующие стекла. При переходе от хлора к
иоду т-ра плавления As ЭХ повышается. Они устойчивы на воздухе. Используют АsЭХ
как компоненты халькогенидных стекол и
стеклообразных полупроводников. П. И. Федоров.
===
Исп. литература для статьи «МЫШЬЯКА»: нет данных
Страница «МЫШЬЯКА» подготовлена по материалам химической энциклопедии.
|

