|
АНИЛИН (от араб. ан-нил-индиго) C6H5NH2,
мол. м. 93,2; бесцв. жидкость с характерным запахом; т. затв. -5,96°С,
т. кип. 184,4°С, 92 °С/33 мм рт.ст., 71 °С/9 мм рт. ст.; d204
1,02173, d1515 1,0268, d2020
1,022; nDl5 1,5887, nD20
1,5863;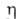 4,4МПа*с (20°С);
4,4МПа*с (20°С);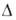 Н°сгор
-3392,15 кДж/моль, Н°сгор
-3392,15 кДж/моль,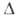 Hообр
—31,1 кДж/моль, Hообр
—31,1 кДж/моль,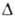 Ноисп
44,35 кДж/моль, Ноисп
44,35 кДж/моль,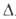 H°пл 8,17 кДж/моль; теплопроводность 177,53 Вт/(м*К)
(0-20°С); С°р 3,105 кДжДкг*К); tкрит
425,65 °С, ркрит 5,134 МПа, vкрит
274см3/моль;
H°пл 8,17 кДж/моль; теплопроводность 177,53 Вт/(м*К)
(0-20°С); С°р 3,105 кДжДкг*К); tкрит
425,65 °С, ркрит 5,134 МПа, vкрит
274см3/моль;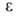 7,06 (20°С), 6,987 (25°С);
7,06 (20°С), 6,987 (25°С);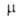 5,19*10-30 Кл*м (25 °С). В спектре поглощения
5,19*10-30 Кл*м (25 °С). В спектре поглощения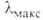 230
нм (lg 230
нм (lg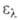 3,98)
и 280 нм (lg 3,98)
и 280 нм (lg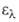 3,16). Смешивается во всех соотношениях с большинством орг. р-рителей,
р-римость А. в воде и воды в А. (% по массе): соотв. 4,5 и 7,2 (60°С),
6,4 и 9,9 (90°С). Образует с большинством углеводородов и их галогензамещенными
азеотропные смеси с минимумом темп-ры кипения и азеотроп с водой (18% А.,
т. кип. 91,5°С).
3,16). Смешивается во всех соотношениях с большинством орг. р-рителей,
р-римость А. в воде и воды в А. (% по массе): соотв. 4,5 и 7,2 (60°С),
6,4 и 9,9 (90°С). Образует с большинством углеводородов и их галогензамещенными
азеотропные смеси с минимумом темп-ры кипения и азеотроп с водой (18% А.,
т. кип. 91,5°С).
А. - основание более слабое (К 5,2*10-10 при 25°С,
1,7*10-9 при 60°С), чем амины жирного ряда, что объясняется
уменьшением электронной плотности у атома N вследствие сопряжения его неподеленной
пары электронов с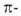 электронами
бензольного ядра. При действии электроф. агентов в А. легко замещаются
атомы Н в орто-и пара-положениях. С минер. к-тами А. образует
соли, напр. C6H5NH3C1 (т. пл. 198°С, т.
кип. 245 °С), C6H5NH3Br (т. пл. 286°С),
C6H5NH2*H3AsO4 (т.
пл. 140°С). С H2SO4 А. образует сульфат, к-рый при
200 °С переходит в сульфаниловую к-ту. А. легко образует соль диазония,
сочетанием к-рой со мн. реагентами и самим А. синтезируют азокрасители.
Алкилируется по атому N алкилхлоридами, олефинами, в присут. Н2 -
альдегидами и кетонами. В пром-сти N-алкиланилины и N,N-диалкиланилины
получают каталитич. взаимод. А. со спиртами. При пропускании паров А. над
активной А12О3 при 400°С, а также при нагр. А. с
его гидрохлоридом при повыш. давлении образуется дифениламин. электронами
бензольного ядра. При действии электроф. агентов в А. легко замещаются
атомы Н в орто-и пара-положениях. С минер. к-тами А. образует
соли, напр. C6H5NH3C1 (т. пл. 198°С, т.
кип. 245 °С), C6H5NH3Br (т. пл. 286°С),
C6H5NH2*H3AsO4 (т.
пл. 140°С). С H2SO4 А. образует сульфат, к-рый при
200 °С переходит в сульфаниловую к-ту. А. легко образует соль диазония,
сочетанием к-рой со мн. реагентами и самим А. синтезируют азокрасители.
Алкилируется по атому N алкилхлоридами, олефинами, в присут. Н2 -
альдегидами и кетонами. В пром-сти N-алкиланилины и N,N-диалкиланилины
получают каталитич. взаимод. А. со спиртами. При пропускании паров А. над
активной А12О3 при 400°С, а также при нагр. А. с
его гидрохлоридом при повыш. давлении образуется дифениламин.
При взаимод. А. с CS2 получают 2-меркаптобензотиазол (каптакс)
и ди(2-бензотиазолил)дисульфид (альтакс), а также N,N'-дифенилтиомочевину
- промежут. продукт в синтезе индиго, изатина и N,N-дифенилгуанидина; каптакс,
альтакс и дифенилгуанидин - ускорители вулканизации. Конденсацией А. с
формальдегидом с послед. фосгенированием образующегося n,n'-диаминодифенилметана
синтезируют дифенилметандиизоцианат - сырье в произ-ве полиуретанов, при
гидрировании А. на никелевых кат. - циклогексиламин, являющийся промежут.
продуктом в произ-ве капролактама.
Осн. способ произ-ва А.-каталитич. восстановление нитробензола водородом
в газовой или жидкой фазе. Газофазный процесс осуществляют в трубчатом
контактном аппарате при 250-350°С на никель- или медьсодержащем кят
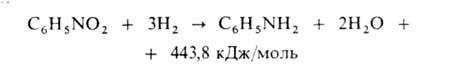
А. отделяется от воды расслаиванием и очищается дистилляцией; реакц.
вода обезвреживается биохимически. Для получения 1 т А. расходуется 1,35
т нитробензола, 800 м3 Н2 и 1 кг катализатора.
В жидкой фазе А. получают при повыш. давлении Н2 (до 1,1
МПа) и 160-170°С на никелевом или палладиевом кат. с одноврем. отгонкой
воды и А. благодаря теплоты р-ции.
А. получают также аммонолизом фенола при 300-600 СС и давлении
выше 1 МПа в адиабатич. реакторе с неподвижным слоем катализатора (А12О3
или алюмосиликат). Конкурентноспособность метода зависит от доступности
фенола в сравнении с нитробензолом.
Качественно А. обнаруживают по фиолетовому окрашиванию его водного р-ра
под действием хлорной извести, а также по образованию азокрасителей при
диазотировании с послед. азосочетанием с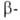 нафтолом
или др. азосоставляющей. Количественно определяют диазотированием или методом
газовой хроматографии. нафтолом
или др. азосоставляющей. Количественно определяют диазотированием или методом
газовой хроматографии.
С начала пром. произ-ва (1847) А. использовали гл. обр. для получения
красителей, после 2-й мировой войны - в осн. в произ-ве ускорителей вулканизации,
с 70-х гг. - в произ-ве полиуретанов. А. применяют также для произ-ва лек.
ср-в и пестицидов.
Для А. т. всп. 79°С, т. самовоспл. 493°С, КПВ (при 140°С) 1,2-8,3%.
Температурные пределы воспламенения 70-90°С; тушить водой. Превращает гемоглобин
в метгемоглобин; ПДК 0,1 мг/м3.
А. впервые получен в 1826 О. Унфердорбеном при перегонке индиго с известью
и назван им "кристалликом". В 1834 Ф. Pyнгe обнаружил А. в кам.-уг. смоле
и назвал "кианолом". В 1841 Ю.Ф. Фришце получил А. нагреванием индиго с
р-ром КОН и назвал его "анилином". В 1842 А. был получен Н. Н. Зининым
восстановлением нитробензола действием (NH4)2SO3
и назван им "бензидамом". В 1843 А. В. Гофман установил идентичность всех
перечисленных соединений. Мировое произ-во А. ок. 1 млн. т/год.
===
Исп. литература для статьи «АНИЛИН»: Николаев Ю. Т., Якубсон А. М., Анилин, М., 1984; Новикова
Ю. А., "Хим. пром-сть за рубежом", 1982, № 2; Kirk-Othmer encyclopedia,
3 ed., v. 2, N.Y.-[a.o.], 1978, p. 309-21. Ю.Т. Николаев.
Страница «АНИЛИН» подготовлена по материалам химической энциклопедии.
|

