|
НЕРАВНОВЕСНАЯ
ХИМИЧЕСКАЯ КИНЕТИКА, изучает кинетич. закономерности хим. р-ций при
сильном нарушении термодинамич. равновесия в реагирующей системе или физ.-хим.
среде, в к-рой они протекают. Любая хим. р-ция нарушает термодинамич. равновесие
в системе, но во мн. случаях это нарушение мало, и если нет внеш. источников
возмущения состояния системы, то при кинетич. расчетах неравновесностью либо
пренебрегают, либо учитывают как второстепенный фактор, вводя малые поправки
к константам скорости р-ций. В таких случаях говорят о р а в н о в е с н о й
к и н е т и к е (условно, поскольку хим. состав системы должен быть неравновесным,
иначе скорости всех р-ций были бы равны нулю). Константы скорости в равновесной
кинетике выражаются в виде ф-ций от термодинамич. параметров среды, напр. т-ры
и давления.
В условиях термодинамич.
равновесия относит. заселенность i-го энергетич. уровня Ni /N
(N-полное число молекул, Ni—число молекул на энергетич.
уровне Ei)зависит от т-ры Т окружающей среды и описывается
ф-л о й Б о л ь ц-м а н а:
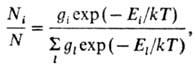
где k-постоянная
Больцмана, gi, gl-числа возможных квантовых состояний
молекулы на уровнях с энергиями Еi и Еl соотв.
(суммирование проводится по индексу l). Если оператор энергии (гамильтониан)
системы допускает разделение переменных, то энергию Еi можно
выразить в виде суммы энергий независимых или слабо связанных подсистем. В газах
Еi можно представить в виде суммы энергий поступат. и вращат.
движений молекул, внутримол. колебаний и электронного возбуждения, причем каждый
вид энергии описывается своей ф-цией распределения типа ф-лы Больцмана.
При отклонении от равновесия
все или нек-рые из распределений частиц по энергиям типа больцмановского не
реализуются. Это может приводить к качеств. и количеств. изменениям кинетики
р-ций. Не существует признаков, позволяющих разделить хим. кинетику на неравновесную
и равновесную. Строго
судить об этом нельзя ни по величине относит. отклонения заселенности конкретных
энергетич. уровней от равновесной заселенности Ni /N, ни по
числу таких уровней, ни по отличию константы скорости р-ции от ее равновесного
значения и т.п. В общем случае можно говорить только об условных границах в
зависимости от требуемой точности решения конкретной кинетич. задачи. Однако
по мере удаления от таких "размытых" границ признаки неравновесных
хим. р-ций становятся все более определенными и м. б. установлены на основе
общих качеств. сопоставлений характерных времен релаксационных процессов в газах
и конденсир. средах (т. е. по иерархии времен релаксации). Система, выведенная
из состояния тер-модинамич. равновесия, возвращается к нему (релаксирует) в
результате обмена энергией при столкновениях частиц неравномерно, с перераспределением
по типам движений (степеням свободы молекулы). В газах равновесие м. б. достигнуто
быстрее всего для поступат. движения частиц, имеющих одинаковые (или близкие
по величине) массы. Колебат. движение, как правило, не обменивается энергией
с поступат. движением в процессе столкновения. Молекула может претерпеть значит.число
столкновений, прежде чем она приобретет или потеряет квант колебат. энергии.
Обычно в системе сначала устанавливается общее равновесие поступат. и вращат.
движений. Колебат. релаксация, ведущая к равновесию колебаний молекул с их поступат.
и вращат. движениями, требует значительно большего времени.
Если в газовой смеси имеются
частицы, на порядки величин различающиеся по массам, время установления поступат.
равновесия для смеси в целом гораздо больше, чем для отдельных компонент осн.
состава (но не малых примесей). В ионизир. газе вследствие огромного различия
масс электронов и атомов задолго до завершения поступат. релаксации устанавливаются
равновесия отдельно в подсистемах "тяжелых" частиц (атомов и ионов)
и электронов с двумя в общем случае разными т-рами, соотв. Тaпост
и Тэлпост. В процессе колебат. релаксации до его
завершения в зависимости от состава смеси и типа колебаний могут устанавливаться
равновесия по отдельным группам колебат. степеней свободы (колебат. подсистемам),
каждое со своей т-рой Ткол, и между такими группами.
Таким же соотношением (иерархией)
времен релаксации характеризуются мол. жидкости и мол. кристаллы, с тем, однако,отличием,
что в жидкостях поступат. и вращат. движения молекул составляют обычно единое
целое (энергии этих видов движения можно разделить лишь в очень грубом приближении).
В твердых телах все движения атомов и молекул колебательные.
Равновесие по хим. составу,
к к-рому приводят хим. р-ции, как правило, достигается за времена, значительно
большие по сравнению со временем колебат. релаксации. Однако при достаточно
высоких т-рах константы скорости р-ций сильно возрастают как по абс. величине
(см. Аррениуса уравнение), так и в сравнении с временами др. релаксационных
процессов, и в системе создаются условия, при к-рых возмущения, вызываемые хим.
р-цией, релаксировать не успевают. Это относится в особенности к релаксации
тех энергетич. состояний, от заселенности к-рых зависит скорость р-ции. В результате
скорость р-ции становится зависящей от времен колебат. релаксации, а иногда,
в предельных случаях сильной неравновесности, и от времен вращат. и поступат.
релаксаций. Иными словами, устанавливается отрицат. обратная связь между скоростью
р-ции и теми возмущениями, к-рые она вызывает, что можно рассматривать как одно
из проявлений Ле Шателье - Брауна принципа. Зависимость скорости
р-ции от Тпост становится при этом более слабой. Так, в сильных
ударных волнах константа диссоциации при высоких Тпост(в условиях
kTnocт>= D/17, где D- энергия диссоциации)
обычно выражается соотношением
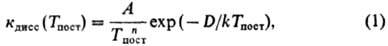
где показатель степени
п принимает значения от 1 до 4, A-эмпирич. постоянная.
Количеств. соотношения
Н. х. к., как правило, значительно сложнее, чем равновесной. Кроме кинетич.
ур-ний для концентраций реагирующих в-в и продуктов приходится иметь дело и
с ур-ниями, выражающими временные зависимости для заселенностей возбужденных
состояний частиц. Такие системы ур-ний, в принципе, можно решать на ЭВМ, если
имеются данные о константах скорости элементарных процессов мол. переноса энергии
- колебательно-вращательного, колебательно-поступательного (колебательно-трансляционного)
и вращательно-трансляционного. В сильно неравновесных условиях решение задач
Н. х. к. обеспечивается не столько возможностью решения полной системы ур-ний
для заселенностей всех энергетич. состояний частиц, сколько правильным выделением
"узкого места" в совокупности элементарных актов, из к-рых слагается
хим. превращение. Для этого нужно определить наиб. быстрые параллельные и наиб.
медленные последовательные переходы и вычислить (или измерить) их константы
скорости - величины, обратные временам жизни молекул в соответствующих возбужденных
состояниях.
Вычисление констант скорости
хим. р-ций упрощается, если в неравновесной в целом системе можно выделить равновесные
подсистемы. Константы скорости р-ций в таких случаях выражаются как ф-ции т-р
подсистем. Напр., константа скорости диссоциации кABдисс
двухатомного газа АВ при высоких Tпост приближенно представляется
в виде ф-лы типа (1), но в экспоненциальный множитель вместо Тпост
входит Ткол, а предэкспоненциальный множитель слабо зависит
от т-ры. Т. к. движение атомов в молекуле носит в осн. колебат. характер, а
кинетика многих хим. превращений связана именно с внутримол. перемещениями атомов,
т-ра Ткол- важнейшая кинетич. и энергетич. характеристика
состояния газа в условиях, описываемых Н. х. к. Для молекул, состоящих из неск.
атомов, константа скорости мономол. распада м. б. при низких давлениях экспоненц.
ф-цией Тпост и Tкол, общей для всех колебаний
(иногда отдельно рассматриваются Ткол для низко- и высокочастотных
колебаний).
В случае р-ций с участием
электронов (ионизация А + е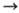 А+ + 2е, диссоциативная рекомбинация АВ+ + е
А+ + 2е, диссоциативная рекомбинация АВ+ + е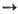 А
+ В и др.) обычно сравнительно быстро устанавливаются электронное равновесие,
характеризующееся т-рой Тэлпост, и поступат.
равновесие, характеризующееся т-рой Тапост. Константа
скорости ионизации атома А с точностью до слабо меняющегося предэкспоненциального
множителя пропорциональна exp(-I/kTэлпост),
где I-потенциал ионизации. Связь между Ткол и Тпост
(или Тэлпост и Тапост)
определяется ур-нием баланса энергии каждой из подсистем, в к-ром учитывается
их взаимод. и вклад подсистемы в энергетику р-ций. Электроны обмениваются энергией
с колебаниями эффективнее, чем с поступат. и вращат. движениями, поэтому до
установления полного равновесия в системе может наступить равновесие между электронной
и колебат. подсистемами, выражающееся в равенстве Ткол = Тэлпост.
Определяя Тэлпост, напр. по данным о свечении
газа, можно косвенно оценить Ткол. А
+ В и др.) обычно сравнительно быстро устанавливаются электронное равновесие,
характеризующееся т-рой Тэлпост, и поступат.
равновесие, характеризующееся т-рой Тапост. Константа
скорости ионизации атома А с точностью до слабо меняющегося предэкспоненциального
множителя пропорциональна exp(-I/kTэлпост),
где I-потенциал ионизации. Связь между Ткол и Тпост
(или Тэлпост и Тапост)
определяется ур-нием баланса энергии каждой из подсистем, в к-ром учитывается
их взаимод. и вклад подсистемы в энергетику р-ций. Электроны обмениваются энергией
с колебаниями эффективнее, чем с поступат. и вращат. движениями, поэтому до
установления полного равновесия в системе может наступить равновесие между электронной
и колебат. подсистемами, выражающееся в равенстве Ткол = Тэлпост.
Определяя Тэлпост, напр. по данным о свечении
газа, можно косвенно оценить Ткол.
Равновесное распределение
колебат. энергии в двухатомном газе (молекулы АВ) при Ткол
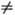 Тпост
осуществляется путем быстрого (почти резонансного) обмена колебат. квантами
по схеме: АВn + АВm Тпост
осуществляется путем быстрого (почти резонансного) обмена колебат. квантами
по схеме: АВn + АВm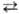 ABnb1
+ АВтb1 (индексами обозначены номера колебат. уровней).
При таком обмене сохраняется общее число колебат. квантов, поэтому равновесие,
к к-рому обмен приводит, характеризуется не только т-рой Тпост,
но и хим. потенциалом m ABnb1
+ АВтb1 (индексами обозначены номера колебат. уровней).
При таком обмене сохраняется общее число колебат. квантов, поэтому равновесие,
к к-рому обмен приводит, характеризуется не только т-рой Тпост,
но и хим. потенциалом m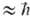 w0
(1 - Тпост/Ткол), где w0
(1 - Тпост/Ткол), где 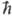 w0
= E1 - E0 (w0- основная
частота колебаний). Для колебат. уровней с энергиями Ei, меньшими
нек-рого значения Ei* (номер уровня i w0
= E1 - E0 (w0- основная
частота колебаний). Для колебат. уровней с энергиями Ei, меньшими
нек-рого значения Ei* (номер уровня i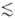 i*),
обмен энергии внутри колебат. подсистемы происходит быстрее, чем между колебаниями
и поступат. движением молекул. Заселенности Xi таких уровней
определяются выражением i*),
обмен энергии внутри колебат. подсистемы происходит быстрее, чем между колебаниями
и поступат. движением молекул. Заселенности Xi таких уровней
определяются выражением
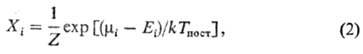
где 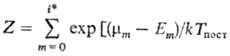 .
.
Константа скорости диссоциации
при этом выражается в виде
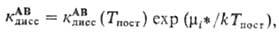
гдe кАВдисс(Тпост)-значение
кАВдисс при Ткол = Тпост.
Распределение (2) переходит в ф-лу Больцмана при Ткол
= Тпост.
В бинарной газовой смеси
двухатомных молекул АВ и CD с близкими частотами колебаний происходит быстрый
обмен колебат. квантами при столкновениях как одинаковых, так и разных молекул.
При этом устанавливается след. соотношение между колебат. т-рами ТколАВ
и ТколCD :
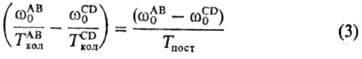
Благодаря соотношениям
(2) и (3) система ур-ний Н. х. к. существенно упрощается, т. к. заселенности
Хi не являются независимыми переменными и выражаются через
небольшое число параметров - Tпост и m (или Тпост
и Ткол).
Выделившаяся при экзотермич.
р-ции энергия во мн. случаях распределена по квантовым состояниям продуктов
не статистически. Но даже в случае статистич. распределения оно неравновесно
относительно окружающей среды. Если в послед. р-ции вступают гл. обр. те промежут.
частицы, к-рые не успели релаксировать (дезактивироваться), то р-ция в целом
описывается в рамках Н. х. к. В частности, к объектам Н. х. к. относятся цепные
р-ции, если активными центрами, ведущими р-цию, являются неравновесно возбужденные
частицы. Т. наз. энергетич. разветвление цепей было экспериментально обнаружено
в смесях Н2 с F2 и СН3I с F2. В
смеси Н2 с F2 разветвление обусловлено генерированием
колебательно возбужденной молекулы HF* по схеме: F + Н2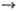 HF*
+ Н с почти резонансной быстрой передачей этого возбуждения на молекулу Н2
и послед. прямой р-цией: HF*
+ Н с почти резонансной быстрой передачей этого возбуждения на молекулу Н2
и послед. прямой р-цией:
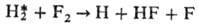
По законам Н. х. к. происходят
нек-рые каталитич. процессы, если активными центрами на каталитич. пов-сти служат
адсорбир. частицы в колебательно- или электронно-возбужденных состояниях.
Распределение колебат.
энергии реагента и константа скорости мономол. р-ции (распада, изомеризации)
взаимно связаны друг с другом в переходной области давлений и в пределе низких
давлений. Механизм Н. х. к. лежит в основе хим. превращений конденсир. систем
в ударных волнах, нек-рых механохим. процессов (см. Механохимия). Особое
место занимает Н. х. к. р-ций, приводящих к образованию колебаний концентраций
промежут. в-в и (или) продуктов (см. Колебательные реакции).
Неравновесность в физ.-хим.
среде возникает практически во всех случаях, когда на скорость и характерные
особенности хим. р-ций (напр., селективность) воздействуют физ. поля. Это м.
б. электрич. поле (дуговой разряд, высокочастотное и СВЧ перем. поле), электромагн.
излучение ИК, УФ, рентгеновского диапазонов частот, ионизирующее излучение (g-кванты,
др. жесткая радиация). Электромагн. излучение взаимод. с электронной подсистемой,
приводя к электронному возбуждению атомов и молекул, ионизации частиц, увеличению
энергии своб. электронов (т-ра Тэлпост) и, как
следствие, к увеличению энергии мол. колебаний (т-ры Ткол).
ИК излучение может и непосредственно возбуждать оптически разрешенные (излучательныe)
колебат. переходы.
Если источник возбуждения
взаимод. не со всеми, а лишь с нек-рыми подсистемами, то при их относительно
медленной релаксации имеется возможность направленного (селективного) возбуждения
таких подсистем. Высокая монохроматичность
лазерного ИК излучения позволяет возбуждать отдельные типы колебаний в молекуле,
находящиеся в резонансе с излучением. Поскольку вероятность того, что колебат.
энергия выделится в результате спонтанного ИК излучения, обычно очень мала,
лазерное колебат. возбуждение способно приводить к очень высокой колебат. т-ре.
Ангармонизм колебаний и
перераспределение энергии между разл. степенями свободы при соударениях молекул
приводят к ограничению направленности действия источника возбуждения системы.
Для достижения наиб. выхода продукта при минимуме затрат энергии нужно, как
правило, возбуждать не одну, а неск. определенных колебат. степеней свободы,
причем не обязательно оптически разрешенных. Это позволяет управлять хим. р-циями:
их скоростью, составом продукта и др. Подобные задачи решаются, в частности,
в плазмохимии, фотохимии, радиационной химии, лазерной химии. Первичные
продукты внеш. воздействия -сильно неравновесные по хим. составу и степени возбуждения
частицы - могут, взаимодействуя, приводить к образованию больших концентраций
др. возбужденных частиц, в т. ч. с инверсной заселенностью, что является необходимым
условием для генерирования лазерного излучения (см. Лазеры химические).
Подходы Н. х. к. плодотворны
для описания мн. прир. процессов. Так, на больших высотах в атмосфере в дневное
время суток под действием солнечной радиации происходит эндотермич. диссоциация
О2 и N2, а в ночное время преобладают обратные процессы
с выделением аккумулированной солнечной энергии. Ниже (на высотах 25-35 км)
формируется озонный слой. Во всех процессах, от к-рых зависит состав верх. слоев
атмосферы, тепловой режим Земли, климат и погода, спектр. состав излучения у
земной поверхности и т. п., важную роль играют возбужденные состояния молекул
и атомов, их повышенная реакц. способность. Во многом благодаря неравновесному
характеру хим. процессов в верх. слоях атмосферы при очень небольшом числе элементов
возникает необычайное многообразие наблюдаемых прир. явлений.
Неравновесные электронно-возбужденные
состояния молекул играют решающую роль в первичных актах фотосинтеза. Кванты
света поглощаются системой молекул хлорофилла, затем по экситонному механизму
энергия возбуждения передается димеру хлорофилла с послед. фотохим. разделением
заряда. Порождаемые внеш. воздействием (светом, хим. превращениями в среде)
неравновесно возбужденные атомы, молекулы, сложные мол. комплексы обусловливают
высокую избирательность биохим. р-ций, управление и самоорганизацию хим., биол.
и физиол. процессов, характерных для живой природы (см. Самоорганизация в
неравновесных процессах).
===
Исп. литература для статьи «НЕРАВНОВЕСНАЯ ХИМИЧЕСКАЯ КИНЕТИКА»: Кондратьев
В. Н., Никитин Е.Е., Кинетика и механизм газофазных реакций, М., 1974; Трое
Ю., Вагнер X., в кн.: Физическая химия быстрых реакций, пер. с англ., М., 1976,
с. 13-105; Полак Л. С., Неравновесная химическая кинетика и ее применение, М.,
1979; Гордиец Б.Ф., Оси-пов А. И., Шелепин Л. А., Кинетические процессы в газах
и молекулярные лазеры, М., 1980; Кузнецов Н. М., Кинетика мономолекулярных реакций,
М., 1982; Крылов О. В., "Кинетика и катализ", 1989, т. 30, вып.
3, с. 519-32.
Н. М. Кузнецов.
Страница «НЕРАВНОВЕСНАЯ ХИМИЧЕСКАЯ КИНЕТИКА» подготовлена по материалам химической энциклопедии.
|

