|
НИКЕЛЬ (от нем. Nickel-имя
горного духа, по поверью, вводившего в заблуждение горняков; лат. Niccolum)
Ni, хим. элемент VIII гр. периодич. системы, ат. н. 28, ат. м. 58,69. Прир.
Н. состоит из пяти изотопов; 58Ni (67,88%), 60Ni (26,23%),
61Ni (1,19%), 62Ni (3,66%) и 64Ni(l,04%). Конфигурация
внеш. электронных оболочек атома 3s23p63d84s2;
степени окисления + 2, редко + 1, +3 и +4; энергии ионизации Ni0
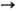 Ni+ Ni+
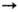 Ni2+ Ni2+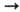 Ni3+
7,634, 18,153 и 35,17 эВ; электроотрицательность по Полингу 1,80; атомный радиус
0,124 нм, ионный радиус (в скобках указаны координац. числа) Ni2+
0,069 нм (4), 0,077 нм (5), 0,083 нм (6). Ni3+
7,634, 18,153 и 35,17 эВ; электроотрицательность по Полингу 1,80; атомный радиус
0,124 нм, ионный радиус (в скобках указаны координац. числа) Ni2+
0,069 нм (4), 0,077 нм (5), 0,083 нм (6).
Среднее содержание Н. в
земной коре 8-10-3% по массе, в воде океанов 0,002 мг/л. Известно
ок. 50 минералов Н., из них важнейшие: пентландит (Fe,Ni)9S8,
миллерит NiS, гарниерит (Ni,Mg)3Si4O10(OH)10.4H2O,
ревдинскит (не-пуит) (Ni,Mg)3Si2O5(OH)4,
никелин NiAs, аннабергит Ni3(AsO4)2•8Н2О.
В основном Н. добывают из сульфидных медно-никелевых руд (Канада, Австралия,
Юж. Африка) и из силикатно-окисленных руд (Новая Каледония, Куба, Филиппины,
Индонезия и др.). Мировые запасы Н. на суше оцениваются в 70 млн. т.
Свойства. Н.-серебристо-белый
металл. Кристаллич. решетка гранецентрир. кубическая, а = 0,35238 нм,
z = 4, пространств. группа Рт3т. Т. пл. 1455 °С. т.
кип. 2900 °С; плота. 8,90 г/см3; C0p
26,l Дж/(моль.К); DH0пл 17,5
кДж/моль, DH0исп 370кДж/моль; S0298
29,9 ДжДмоль•К); ур-ние температурной зависимости давления пара для твердого
Н. lgp(гПа) = 13,369-23013/T+0,520lgT+0,395T (298-1728К),
для жидкого lgp(гПа)=11,742-20830/T+ 0,618 lg Т (1728-
3170 К); температурный
коэф. линейного расширения 13,5.10-6 К-1 (273-373
К); теплопроводность 94,1 Вт/(м х х К) при 273 К, 90,9 Вт/(м.К) при
298 К; g 1,74 Н/м (1520 °С); r 7,5•10-8 Ом•м, температурный коэф.
r 6,75.10-3 К-1 (298-398 К); ферромагнетик,
точка Кюри 631 К. Модуль упругости 196-210 ГПа; sраст 280-720 МПа;
относит. удлинение 40-50%; твердость по Бринеллю (отожженного) 700-1000 МПа.
Чистый Н.- весьма пластичный металл, хорошо обрабатывается в холодном и горячем
состоянии, поддается прокатке, волочению, ковке.
Н. химически малоактивен,
но тонкодисперсный порошок, полученный восстановлением соединений Н. водородом
при низких т-рах, пирофорен. Стандартный электродный потенциал Ni0/Ni2+
- 0,23 В. При обычных т-рах Н. на воздухе покрывается тонкой защитной пленкой
никеля оксида. Не взаимод. с водой и влагой воздуха. При нагр. окисление
Н. с пов-сти начинается при ~ 800 °С. С соляной, серной, фосфорной, фтористоводородной
к-тами Н. реагирует очень медленно. Практически на него не действуют уксусная
и др. орг. к-ты, особенно в отсутствие воздуха. Хорошо реагирует с разб. HNO3,
конц. HNO3 пассивируется. Р-ры и расплавы щелочей и карбонатов щелочных
металлов, а также жидкий NH3 на Н. не действуют. Водные р-ры NH3
в присут. воздуха коррелируют Н.
Н. в дисперсном состоянии
обладает большой каталитич. активностью в р-циях гидрирования, дегидрирования,
окисления, изомеризации, конденсации. Используют либо скелетный Н. (никель Ренея),
получаемый сплавлением с Аl или Si с послед. выщелачиванием щелочью, либо Н.
на носителе.
Н. поглощает Н2
и образует с ним твердые р-ры. Гидриды NiH2 (устойчив ниже 0°С)
и более стабильный NiH получены косвенными путями. Азот почти не поглощается
Н. вплоть до 1400 °С, р-римость N2 в металле 0,07% при 450 °С.
Компактный Н. не реагирует с NH3, дисперсный при 300-450 °С образует
с ним н и т р и д Ni3N.
Расплавленный Н. растворяет
С с образованием к а р б и д а Ni3C, к-рый при кристаллизации расплава
разлагается с выделением графита; Ni3C в виде серо-черного порошка
(разлагается при ~ 450°С) получают науглероживанием Н. в атмосфере СО при
250-400 °С. Дисперсный Н. с СО дает летучий никеля тетракарбонил Ni(CO)4.
При сплавлении с Si образует с и л и ц и д ы; Ni5Si2,
Ni2Si и NiSi плавятся конгруэнтно соотв. при 1282, 1318 и 992 °С,
Ni3Si и NiSi2 -инконг-руэнтно соотв. при 1165 и 1125°С,
Ni3Si2 разлагается, не плавясь, при 845 °С. При сплавлении
с В дает б о р и д ы: Ni3B (т. пл. 1175°С), Ni2B (1240
°С), Ni3B2 (1163°C), Ni4B3 (1580
°С), NiB12 (2320 °С), NiB (разлагается при 1600 °С).
С парами Se Н. образует с е л е н и д ы: NiSe (т. пл. 980 °С), Ni3Se2
и NiSe2 (разлагаются соотв. при 800 и 850 °С), Ni6Se5
и Ni21Se20 (существуют только в твердом состоянии). При
сплавлении Н. с Те получают т е л л у р и д ы: NiTe и NiTe2 (между
ними образуется, по-видимому, широкая область твердых р-ров) и др.
С парами фосфора Н. образует
ф о с ф и д ы: Ni5P2 и Ni2P с т. пл. соотв.
1180 и 1110 °С, а также Ni3P, разлагающийся по перитектич. р-ции
при 970 °С. Известны также высшие фосфиды NiP3, NiP2
и др., разлагающиеся при нагр. с отщеплением Р и образованием Ni2P.
Н. сплавляется с As и Sb. Известно 5 а р с е н и д о в Н.; Ni5As2
и NiAs плавятся конгруэнтно соотв. при 998 и 964 °С. Моноарсенид NiAs кристаллизуется
в гексагoн. решетке (а = 0,3963 нм, с = 0,5049 нм, z = 2, пространств.
группа P63/mmc). Диарсенид NiAs2 (минерал
раммельсбергит) образует две модификации ром-бич. сингонии; при нагр. диссоциирует
на As и NiAs.
Безводные соли Н. большей
частью желтые, гидратиро-ванные - зеленые. О важнейших солях Н. см. Никеля
гало-гениды, Никеля сульфат и др.Ф о с ф а т Ni3(PO4)2-желтое
аморфное или кристаллич. в-во; кристаллич. решетка моноклинная (а = 0,5830
нм, b = 0,4700 нм, с = 1,0107 нм, b= = 91,22°, пространств.
группа P21/c); т. пл. 1350°С; плотн. 4,38 г/см3;
дает октагидрат зеленого цвета, к-рый обезвоживается при 110-260 °С с промежут.
образованием гепта-и дигидрата; р-римость в воде 0,068% при 20 °С; компонент
катализаторов, термостойких
лакокрасочных покрытий, октагидрат - термочувствит. пигмент. П и р о ф о с ф
а т Ni2P2O7-желтые кристаллы с моноклинной
решеткой (а = = 1,3093 нм, b = 0,8275 нм, с = 0,8974 нм,
b = 104,94°, z = 8, пространств. группа P21/c);
плотн. 4,09 г/см3; ок. 600 °С переходит в другую моноклинную
модификацию; т. пл. 1395°С; образует гептагидрат; не раств. в воде, к-тами
разлагается; пигмент для лаков и красок.
А р с е н а т Ni3(AsO4)2.8H2O-зеленые
кристаллы; р-римость в воде 0,022%; к-тами разлагается; выше 200 °С обезвоживается,
при ~ 1000°С разлагается; катализатор получения твердого мыла.
С и л и к а т Ni2SiO4-светло-зеленые
кристаллы с ромбич. решеткой; плотн. 4,85 г/см3; разлагается, не
плавясь, при 1545°С; в воде не раств.; минер. к-тами медленно разлагается
при нагревании. А л ю м и н а т NiAl2O4 (никелевая шпи-нель)-голубые
кристаллы с кубич. решеткой; т. пл. 2110°С; плотн. 4,50 г/см3;
не раств. в воде; медленно разлагается к-тами; катализатор гидрирования.
Важнейшие комплексные соед.
Н.-а м м и н ы. Наиб. характерны гексааммины и акватетраммины с катионами соотв.
[Ni(NH3)6]2+ и [Ni(NH3)4(H2O)2]2+.
Это голубые или фиолетовые кристаллич. в-ва, обычно раств. в воде, в р-рах ярко-синего
цвета; при кипячении р-ров и при действии к-т разлагаются; образуются в р-рах
при аммиачной переработке никелевых и кобальтовых руд.
При растворении Ni(CN)2
в р-рах цианидов щелочных металлов образуются цианоникелаты K2[Ni(CN)4]
(желтый) и K4[Ni(CN)6] (красный). При восстановлении K2[Ni(CN)4]
в аммиачных р-рах м.б. получены комплексы Ni(0) и Ni(I), напр. K4[Ni(CN)4]
(красный), K3[Ni(CN)4] (светло-красный) и K4[Ni2(CN)6]
(фиолетово-красный), легко окисляющиеся на воздухе.
В комплексах Ni(III) и
Ni(IV) координац. число Н. равно 6. Примеры-фиолетовый K3[NiF6]
и красный K2[NiF6], образующиеся при действии F2
на смеси NiCl2 и КСl; сильные окислители. Из др. типов известны соли
гетеро-поликислот, напр. (NH4)6H7[Ni(MoO4)6].5H2O,
большое число внутрикомплексных соед. Ni(II). См. также Никель-органические
соединения.
Получение. Руды
перерабатывают пиро- и гидромстал-лургич. путем. Для силикатно-окисленных руд
(не поддаются обогащению) используют либо восстановит. плавку с получением ферроникеля,
к-рый далее подвергают продувке в конвертере с целью рафинирования и обогащения,
либо плавку на штейн с серосодержащими добавками (FeS2 или CaSO4).
Полученный штейн продувают в конвертере для удаления Fe, а затем дробят и обжигают,
из образовавшегося NiO восстановит. плавкой получают металлический Н. Никелевые
концентраты, получаемые при обогащении сульфидных руд, плавят на штейн с послед.
продувкой в конвертере. Из медно-никелевого штейна после его медленного охлаждения
флотацией выделяют концентрат Ni3S2, к-рый, аналогично
штейнам из окисленных руд, обжигают и восстанавливают.
Один из путей гидропереработки
окисленных руд-восстановление руды генераторным газом или смесью Н2
и N2 с послед. выщелачиванием р-ром NH3 и СО2
с продувкой воздуха. Р-р очищают от Со сульфидом аммония. При разложении р-ра
с отгонкой NH3 осаждается гидроксо-карбонат Н., к-рый либо прокаливают
и из образовавшегося NiO восстановит. плавкой получают Н., либо повторно раств.
в р-ре NH3 и после отгонки NH3 из пульпы восстановлением
Н2 получают Н. Др. путь - выщелачивание окисленной руды серной к-той
в автоклаве. Из образовавшегося р-ра после его очистки и нейтрализации Н. осаждают
сероводородом под давлением и полученный концентрат NiS перерабатывают подобно
штейнам.
Гидропереработка сульфидных
никелевых материалов (концентратов, штейнов) сводится к автоклавному окислит.
выщелачиванию либо р-рами NH3 (при низком содержании Со), либо H2SO4.
Из аммиачных р-ров после отделения CuS Н. осаждают водородом под давлением.
Для разделения Ni, Со
и Сu из аммиачных р-ров применяют также экстракц. способы с использованием,
в первую очередь, хелатообразу-ющих экстрагентов.
Автоклавное окислитю выщелачивание
с получением сульфатных р-ров применяют как к обогащенным материалам (штейнам)
с переводом Н. и др. металлов в р-р, так и к бедным пирротииовым Fe7S8
концентратам. В последнем случае окисляется преим. пирротин, что позволяет выделить
элементарную S и сульфидный концентрат, переплавляемый далее на никелевый штейн.
Рафинирование Н. проводят
обычно электролизом в сульфатных или сульфатно-хлоридных р-рах с очисткой электролита
от Сu (цементацией на активном никелевом порошке), Fe и Со (их окислением и
осаждением с помощью гидроксо-карбоната Н.), Zn (ионным обменом) и т.д. Чистый
Н. также получают (в виде порошка или дроби) термич. разложением карбонила.
Определение. Качественно
Н. обнаруживают йо образованию в аммиачной среде розовато-красного соед. с диметилглиоксимом,
р-цией с рубеановодородной к-той [NH2C(S)C(S)NH2] в слабокислой
среде (сине-фиолетовое окрашивание) и др. Количественно Н. определяют путем
осаждения диметилглиоксимом или электрогравиметриче-ски, а также титрованием
комплексонами, KCN, диметилглиоксимом, фотометрически. Применяют полярографич.,
эмиссионный, рентгеноспектральный флуоресцентный и атомно-абсорбционный методы.
Применение. В основном
Н. используют как компонент легированных сталей, жаростойких, сверхтвердых,
магнитных, коррозионностойких и др. сплавов (см. Никеля сплавы). Металлический
Н.-конструкц. материал для хим. аппаратуры и ядерных реакторов, для аккумуляторных
электродов, материал покрытий на стали, чугуне, алюминии и др. металлах.
Н.-необходимый микроэлемент
для млекопитающих и растений. В организме взрослого человека содержится 5-13,5
мг Н.
Н. обладает общетоксич.
действием, а также вызывает заболевания носоглотки, легких, злокачеств. новообразования,
дерматиты, экземы. В атм. воздухе ПДК (среднесуточная) для металлического Н.,
его оксидов и сульфата 0,001 мг/м3, для р-римых солей в виде гидроаэрозоля
0,0002 мг/м3, в воздухе рабочей зоны ПДК 0,005 мг/м3.
Для металлического Н. ПДК в воде 0,1 мг/л, в почве 3,0 мг/кг.
Мировое произ-во Н. (без
СССР) до 700 тыс. т/год (в 1985-550 тыс. т). Осн. производители - Канада, Япония,
США, Новая Каледония, Австралия, Индонезия, Филиппины, ЮАР.
Н. в виде металла впервые
получил в 1751 А. Кронстедт. Сплав с Сu и Zn применяли еще в Древнем Китае.
===
Исп. литература для статьи «НИКЕЛЬ»: Перельман
Ф. М., Зворыкин А.Я., Кобальт и никель, М., 1975; Худяков И. Ф., Тихонов A.И.,
Деев В. И., Металлургия меди, никеля и кобальта, т. 2-Металлургия никеля и кобальта,
2 изд., М., 1977; Борбат В. Ф., Лещ И. Ю., Новые процессы в металлургии никеля
и кобальта, М., 1976; Борбат В. Ф., Воронов А. Б., Автоклавная технология переработки
пикель-пирротиновых концентратов, М., 1980; Диомидовский Д. А., Онищин Б. И.,
Линев В. Д., Металлургия ферроникеля, М., 1983. П. И. Федоров.
Страница «НИКЕЛЬ» подготовлена по материалам химической энциклопедии.
|

