|
НИТРОЗИЛА СОЕДИНЕНИЯ,
неорг. соед., содержащие группу —NO или ион NO+, называемый нитрозилом
или нитрозонием. Переход от молекулы NO (потенциал ионизации 9,27 эВ) к иону
NO + сопровождается упрочением и укорочением связи N—О; энергия диссоциации
связи увеличивается от 627 до 1047 кДж/моль, длина связи сокращается от 0,11507
до 0,1063 нм. В ковалентных Н.с. NOX, где X = F, Сl, Вr, положит. заряд на атоме
N значительно ниже единицы, а длина связи N—О имеет промежут. значение между
длинами связей в NО+ и NO. Так, в NOF длина связи N—О 0,1136 нм,
в NOCl-0,1143 нм и в NOBr-0,1146 нм, угол NOX меняется от 110°С в NOF до
114,5°в NOBr.
Н и т р о з и л ф т о р
и д NOF-бесцв. газ; т. пл. — 132,5°С, т. кип. ~59,9°С; плотн. 1,326
г/см3. (-59,9°С); С0p 41,5
Дж/(моль.К); DH0обр —65,0 кДж/моль;
с безводным HF образует ряд соед. NOF•nHF, где п = 3,4,6 и 7,
имеющих строение гидрофторидов NOНnFn+1;
для NOH3F4 т. кип. 94 °С, т. пл.-1°С; активный
фторирующий агент (напр., в технологии ядерного горючего), в смеси с жидким
HF-перспективный р-ритель для металлов и их оксидов.
Н и т р о з и л х л о р
и д NOCl-красный газ; т. пл. — 61 °С, т. кип. -5,7°С; C0p
44,6 Дж/(моль.К); DH0обр 52,7 кДж/моль;
применяют при нитрозировании алканов, напр., циклогекса-на в произ-ве
капролактама. Нитрозилбромид NOBr неустойчив, уже при комнатной т-ре находится
в равновесии с продуктами распада: NOBr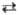 NO
+ 0,5Br2. NO
+ 0,5Br2.
Все нитрозилгалогениды
в воде, особенно в щелочной среде, полностью гидролизуются до NO2
и X-; раств. в неводных средах-СНСl3, HF, CH3CN
и т.п. Получают нитрозилгалогениды действием галогенидов металлов на оксиды
азота или на HNO3, а также р-цией солей нитрозила с галогенидами
щелочных металлов.
При взаимод. NOF с акцепторами
фторид-иона (к-тами Льюиса), такими как BF3, AsF5, SbF5
и др., образуются соли нитрозония NO + : NOBF4, NOAsF6,
NOSbF6, NOPtF6, NOAuF6 и др.; соотв. с NOCl
синтезированы NOBCl4, NOAlCl4, NOFeCl4 и др.
Нитрозильные соли кислородных к-т получают р-цией NOCl или N2O4
с к-тами. Так выделены NOHSO4, NOHSeO4, NOClO4,
NOSO3Cl, (NO)2Se2O7 и др. Соли нитрозония
- гигроскопичные кристаллич. ионные соединения. Их используют как окислители
для перевода металла в комплексах в более высокую степень окисления, для растворения
металлов в неводных средах, напр.:
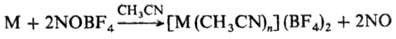
М = Mn, Fe, Co, Ni, Cu,
Pd и др.; для введения нитрозо-группы в орг. молекулы.
Известно большое число
комплексов переходных металлов, содержащих группу NO в качестве лиганда: [Fe(CN)5NO]2-,
[Ir(NO)2(PPh3)2]+ и т.п.; в них
группа NO несет отрицат. заряд. B. Я. Росоловский.
===
Исп. литература для статьи «НИТРОЗИЛА СОЕДИНЕНИЯ»: нет данных
Страница «НИТРОЗИЛА СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.
|

