|
НИТРОЗОСОЕДИНEНИЯ (С-нитрозосоединения),
содержат в молекуле одну или неск. нитрозогрупп —N=O, связанных с атомами углерода.
Известны также N- и О-нитрозосоединения (см. Нитрозамины и Нитриты
органические). Обычно Н. существуют в виде равновесной смеси мономера и
димера (для последнего характерна геом. изомерия):
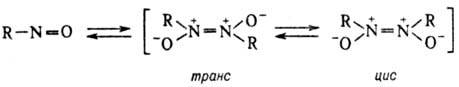
Назв. мономерных Н. производят
прибавлением префикса "нитрозо" к назв. соединения-основы.
В индивидуальном состоянии
большинство Н. находятся в виде димеров, однако введение электроноакцепторных
заместителей в орг. остаток приводит к преобладанию мономеров (напр., трихлор-
и трифторнитрозометаны). В димер-ных Н. транс-изомеры стабильнее
цис-изомеров. В р-рах или при нагр. димерные Н. диссоциируют, по крайней
мере частично. Вицинальные ароматические Н. или непредельные димерные Н. димеризуются
специфически, давая фуроксаны, а перфторалкильные Н. при облучении димеризуются
в соответствующие О-нитрозогидроксиламины, напр.:
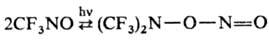
Нитрозогруппа в мономерных
и димерных Н.-плоская, напр. для нитрозометана длины связей 0,149 нм (С—М) и
0,122 нм (N—О), угол CNO 112,6°.
Физические свойства.
Мономерные Н.-газы или жидкости голубого или зеленого цвета, хорошо раств.
во мн. орг. р-рителях, димерные Н.-бесцв. кристаллы, раств., как правило, в
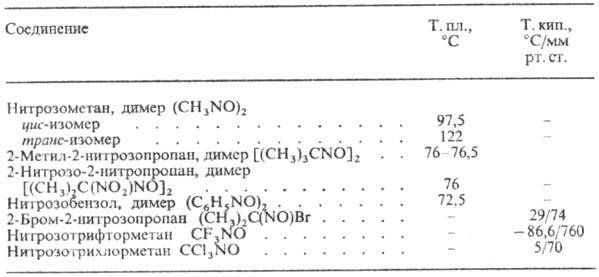
полярных р-рителях. Св-ва нек-рых Н. приведены в таблице.
В И К спектрах Н. присутствуют
интенсивные полосы, соответствующие валентным колебаниям группы NO: для мономерных
алифатических и ароматических Н. при 1540-1620 или 1500-1512 см-1
соотв.; для транс-димеров алифатических и ароматических Н. при 1176-1290
и 1253-1299 см-1; у цис-димеров эти полосы смещены в область
больших частот и проявляются в виде дублетов при 1323-1344 и 1330-1420 см-1
(алифатические Н.) и 1389 и 1409 см-1 (ароматические Н.).
СВОЙСТВА НЕКОТОРЫХ НИТРОЗОСОЕДИНЕНИЙ
В УФ спектрах мономерных
Н. наблюдаются три максимума: 630-790 нм (e  45-60,
п 45-60,
п p-переход),
270-290 нм (e p-переход),
270-290 нм (e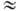 80,
о 80,
о p*-переход)
и 220 нм (e p*-переход)
и 220 нм (e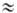 5.103,
п 5.103,
п p*-пере-ход).
Для транс-димеров lмакс 280-300 нм (e p*-пере-ход).
Для транс-димеров lмакс 280-300 нм (e 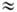 5.103
-— 12.103, p 5.103
-— 12.103, p p*-переход),
а для цис-димеров этот максимум сдвинут в коротковолновую область на
10-15 нм. p*-переход),
а для цис-димеров этот максимум сдвинут в коротковолновую область на
10-15 нм.
В спектрах ПМР Н. хим.
сдвиги a-Н-атома близки к хим. сдвигам аналогичных протонов в соответствующих
нитро-соед., причем они различны для мономеров и цис-, и таранс-димеров
Н., что позволяет оценить их количественно в равновесной смеси. В спектре ЯМР
на ядрах N хим. сдвиги Н. весьма характерны, хотя и проявляются в широком диапазоне
в значительно более сильных полях, чем в соответствующих нитросоед. (5 от 300
до 550 м.д.).
Химические свойства.
Особенность алифатических Н., содержащих a-Н-атом,-их необратимая изомеризация
в оксимы:
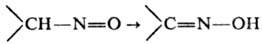
Р-ция катализируется основаниями,
водой и полярными р-рителями. Окислители (О3, Н2О2,
орг. перкислоты, О2 воздуха и др.) окисляют Н. в соответствующие
нитросоединения. Восстановление Н. в зависимости от восстановителя приводит
к гидроксиламинам [NaBH4, арсенат (III) и т. п.] или к аминам (металл
в к-те, Н2 над Ni-Ренея и др.), причем процесс осложняется конденсацией
Н. с промежуточными и конечными продуктами соотв. в азокси- и азосоединения.
При действии производных Р(III) происходит дезоксигенирование Н. с образованием
нитренов 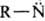 , к-рые далее конденсируются с исходным Н. или вступают во взаимод. с р-рителем.
, к-рые далее конденсируются с исходным Н. или вступают во взаимод. с р-рителем.
Н. взаимод. с N,N-дигалогенаминами
в присут. солей Сu+ с образованием азоксисоед. RN(O)=NR'. Для Н.
характерны р-ции по кратным связям. Так, с олефинами возможны три типа превращений:
а) 1,2-присоединение с образованием оксазетидинов; б) 1,4-присоединение (диеновый
синтез) с образованием дигидрооксазинов; в) конденсация двух молекул Н. с одной
молекулой олефина, приводящая к дигидро-1,3-диокса-2,4-диазинам:
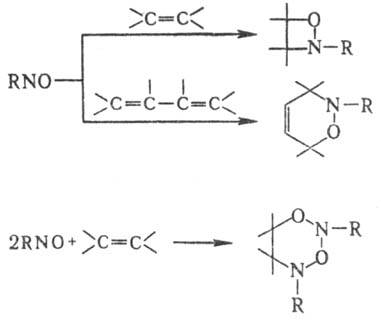
Направление р-ции зависит
от природы Н. и олефина.
С илидами серы Н. взаимод.
по схеме переилидирования, давая нитроны, а с илидами фосфора - по типу р-ции
Витти-га, образуя азометины:
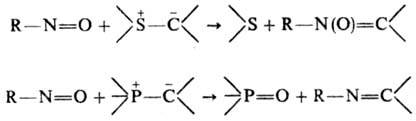
Ароматические Н. реагируют
с соед. с активной метиле-новой группой в присут. основных катализаторов, образуя
N-ариламины или нитроны:
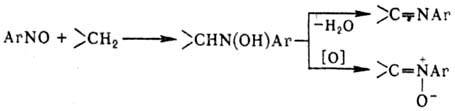
Н. присоединяют HN3
по связи N=O и нек-рые др. к-ты, а также реактивы Гриньяра.
Третичные и ароматические
Н. с активными радикалами R. образуют стабильные нитроксильные радикалы,
напр.:
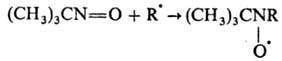
Это св-во позволяет использовать
Н. в спиновых ловушек методе.
Получение. Общий
способ получения Н.-окисление первичных аминов к-той Каро (выход Н. 30-70%)
или гидро-ксиламинов орг. перкислотами, Наl2, HgO и др. Можно использовать
окисление орг. перкислотами азометинов, нитронов (окислителем м. б. также О3)
и диметилсульфид-иминов (в неполярном р-рителе), напр.:
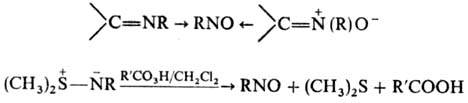
Н. получают также введением
нитрозогруппы в молекулу орг. соед. путем замещения атома водорода (нитрозирование).
Для синтеза функционально замещенных алифатических Н. используют нитрозирование
соед., содержащих активирующие группы [COR, NO2, CN, C(R)=NH] у нитро-зируемого
атома углерода; нитрозирующие агенты-N2O3 или NaNO2/H2SO4.
Нитрозирование этими же реагентами вторичных нитросоед.- общий способ получения
псевдонит-ролов RR'C(NO)NO2. Для получения алифатических Н. можно
использовать радикальное нитрозирование углеводородов, а также действие NO на
алхилиодиды (в синтезе перфторалкилнитрозосоед.), напр.:
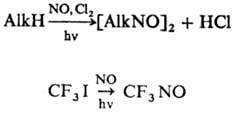
При действии на кетоксимы
галогенов образуются a-хлор-нитрозосоед., в присут. N2O4
— псевдонитролы, при действии тетраацетата Pb-a-ацетоксинитрозосоед., напр.:
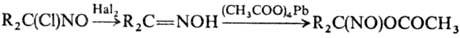
Вицинальные хлор- или нитрозамещенные
Н. получают с хорошим выходом присоединением соотв. NOCl или N2O3
к олефинам. При действии этих же реагентов на Ag-соли или ангидриды карбоновых
к-т карбоксильная группа заменяется на группу NO, напр.:
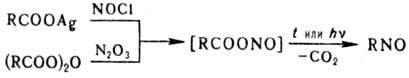
Однако этот метод синтеза
Н. менее распространен.
Нек-рые Н. можно получить
действием NOCl на ртутьорг. производные, напр.:
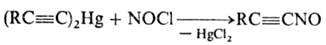
Специфич. методы синтеза
ароматических Н.-нитрозирование ароматич. аминов или фенолов действием NaNO2/
H2SO4 с образованием соотв. пара- и орто-замещенных
продуктов. Для получения ароматических Н. иногда используют внутримол. диспропорционирование,
напр.:
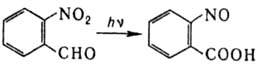
Анализ и применение.
Для обнаружения Н. используют их взаимод. с фенолом (резорцином) и конц.
H2SO4, приводящее к появлению темно-красного окрашивания,
переходящего в темно-голубое после добавления водного р-ра NaOH (р-ция Либермана),
или появление интенсивного голубого окрашивания при обработке Н. смесью H2SO4
с дифениламином. Количественно Н. определяют волюмометрически по выделению азота
после обработки Н. фенилгидразином.
Н. применяют как полупродукты
в синтезе гетероциклич. соед., аминокислот и др. Нитрозофенолы используют для
получения красителей и лек. препаратов, фторсодержащие и нек-рые др. Н.-в синтезе
эластомеров (см. Фторкаучуки)и для отверждения полимерных композиций,
напр. в произ-ве термостойких каучуков.
Нек-рые Н. обладают мутагенной
и канцерогенной активностью, а также вызывают кожные заболевания.
===
Исп. литература для статьи «НИТРОЗОСОЕДИНEНИЯ»: Химия нитро-
и нитрозогрупп, пер. с англ., т. 1, М., 1972, с. 100-19, 158-224; т. 2, М.,
1973, с. 176-220; Общая органическая химия, пер. с англ., т. 3, М., 1982, с.
372-99; Беляев Е. Ю., Гидаспов Б. В., Ароматические нитрозо-соединения, Л.,
1989. С. Л. Иоффе.
Страница «НИТРОЗОСОЕДИНEНИЯ» подготовлена по материалам химической энциклопедии.
|

