|
НИТРОКСИЛЬНЫЕ РАДИКАЛЫ
(аминилоксидные, ими-ноксильные, аминоксильные, азотокисные радикалы), содержат
нитроксильную группу 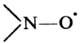 Наиб. изучены органические Н.р. общей ф-лы RR'NO., где R, R'-opr.
остаток. Известны также неорганические Н.р., напр. соль Фреми (NaOSO2)2NO..
В зависимости от числа нитроксильных групп различают моно-, би-, ..., полирадикалы.
Наиб. изучены органические Н.р. общей ф-лы RR'NO., где R, R'-opr.
остаток. Известны также неорганические Н.р., напр. соль Фреми (NaOSO2)2NO..
В зависимости от числа нитроксильных групп различают моно-, би-, ..., полирадикалы.
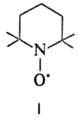
Называют Н.р., добавляя
к систематич. назв. соед. окончание "оксил". Напр., соед. ф-лы I
(везде черточками обозначены группы СH3)-2,2,6,6-тетраметилпиперидин-1-оксил.
Используют также др. способ наименования-добавляют окончание
"нитроксил" к назв. заместителей R и R', напр. (трет-С4Н9)2NO.-ди-тpет-бутилнитроксил,
(С6Н5)2NO.-дифенилнитроксил.
Нитроксильная группа содержит
трехэлектронную связь N—О;
ее строение м.б. изобpажено резонансными ф-лами:
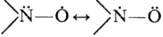
Неспаренный электрон находится
на разрыхляющей p*-орбитали,
образованной из 2pz-орбиталей атомов N и О. Гибридизация связей
атома N близка к sp2. В ди-тpет-алкилнитроксилах
неспаренный электрон
почти полностью локализован на группе N—О, причем спиновые плотности r на атомах
N и О приблизительно равны. Замена алкильного заместителя на ароматический значительно
понижает rN, в то время как rO изменяется мало. Длина
связи N—О в Н.р. 0,123-0,13 нм.
Большое кол-во Н.р. выделено
в индивидуальном состоянии. Для них характерно наличие стерич. затруднений вблизи
радикального центра-гл. обр. третичных атомов С, обрамляющих нитроксильную группу.
Стабильные Н.р.-полярные (для соед. I m 10,6.10-30 Кл.м)
окрашенные твердые в-ва или жидкости, лишь бис-(трифторметил) нитроксил
(CF3)2NO. -газ при нормальных условиях. Примеры
стабильных Н.р.-соед. I-VIII.
Нек-рые Н.р. (напр., соль
Фреми) в твердом состоянии-диамагн. димеры.
В ИК спектрах нитроксилов
колебания группы NO проявляются в области 1340-1370 см-1. Для масс-спектров,
как правило, характерно наличие интенсивного пика мол. иона М+.
Интенсивность пиков ионов [М+1]+ превышает интенсивность
пика изотопного иона. В спектрах ЭПР Н.р. проявляется триплетное расщепление,
обусловленное сверхтонким взаимод. (СТВ) неспаренного электрона с ядром атома
14N. Константа СТВ aN зависит от строения радикала
и характеризуется след. значениями (мТ):

* Квинтетное расщепление.
g-Фактор большинства Н.р.
составляет 2,005-2,006.
Стабильность Н.р. определяется
степенью делокализации неспаренного электрона по связям заместителей и стерич.
затруднениями вблизи атомов с высокой спиновой плотностью. Мн. ди-трет-алкилнитроксилы
хранятся годами без разложения. Диалкилнитроксилы, имеющие a-Н-атомы, быстро
диспропорционируют:
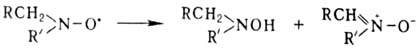
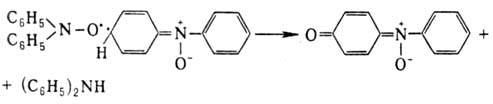
Разложение диарил- и алкиларилнитроксилов
обычно включает стадию бимол. атаки нитроксильной группой по орто-или
nара-положению, напр.:
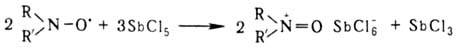
Потенциал окисления стабильных
Н.р. довольно высок; они окисляются в оксоаммониевые соли только такими сильными
окислителями, как Сl2, SbCl5, SnCl4, напр.:
Н.р.-очень слабые основания,
напр.: для соед. I рКа —5,5. В кислых средах они находятся
в равновесии с катион-радикалами 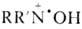 и продуктами их одноэлектронного диспропорционирования:
и продуктами их одноэлектронного диспропорционирования:
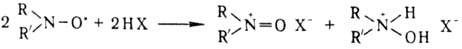
К-ты Льюиса, напр. АlСl3,
образуют с Н.р. парамагн. комплексы донорно-акцепторного типа.
Восстановление Н.р. приводит
к зависимости от природы восстановителя к соответствующим гидроксиламинам RR'NOH
или аминам RR'NH. Щелочные металлы реагируют с Н.р. лишь при повыш. т-ре. Взаимод.
с металлоорг. соед. протекает легко, напр.:
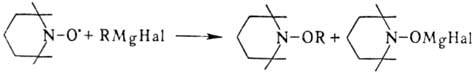
При повыш. т-ре Н.р. реагируют
с углеводородами по схеме:
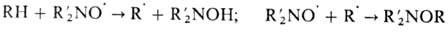
На способности стабильных
Н.р. взаимодействовать с активными алкильными (но не пероксильными) радикалами
основано их ингибирующее действие на цепные радикальные процессы.
На примере стабильных Н.р.
были обнаружены т.наз. р-ции без затрагивания своб. валентности, напр.:
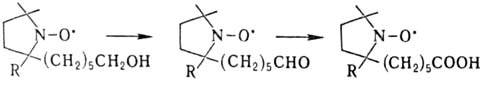
С помощью подобных р-ций
было синтезировано большое число Н.р. На их использовании основан метод спиновых
меток (см. Спинового зонда метод).
Др. важные методы получения
Н.р. включают окисление (окислители PbO2, Ag2O, MnO2
и др.) N,N-диза-мещенных гидроксиламина; окисление вторичных и третичных аминов
(чаще всего используют Н2О2 в присут. вольфрамата Na);
восстановление нитросоед., напр.: 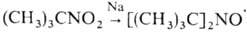 ; присоединение активных радикалов к нитрозосоед. и нитронам, напр.:
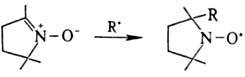
; присоединение активных радикалов к нитрозосоед. и нитронам, напр.:
Последнюю р-цию применяют
в спиновых ловушек методе.
Н. р. используют в научных
исследованиях для изучения механизмов хим. р-ций, как спиновые метки и зонды,
парамагн. модели в биофизике и медицине, стабилизаторы полимеров и др.
===
Исп. литература для статьи «НИТРОКСИЛЬНЫЕ РАДИКАЛЫ»: Бучаченко
А.Л., Вассерман A.M., Стабильные радикалы, М., 1973; Розанцев Э. Г., Шолле В.
Д., Органическая химия свободных радикалов, М., 1979; Нитроксильные радикалы.
Синтез, химия, приложения, М., 1987; Имидазо-линовые нитроксильные радикалы,
Новосиб., 1988. В. Д. Шолле.
Страница «НИТРОКСИЛЬНЫЕ РАДИКАЛЫ» подготовлена по материалам химической энциклопедии.
|

