|
ОКСИДЫ, соединения
элементов с кислородом. В О. степень окисления атома кислорода —2. К О. относятся
все соед. элементов с кислородом, кроме содержащих атомы О, соединенные друг
с другом (пероксиды, надпероксиды, озо-ниды), и соед. фтора с кислородом (OF2
и др.). Последние следует называть не оксидами, а фторидами кислорода, т. к.
степень окисления кислорода в них положительная.
При комнатной т-ре большинство
О.-твердые в-ва (СаО, Fe2O3 и др.), нек-рые-жидкости (Н2О,
Сl2О7 и др.) и газы (NO, SO2 и др.). Хим. связь
в О.-ионная и ионно-ковалент-ная. Т-ры плавления и кипения О. понижаются с возрастанием
в них доли ковалентной связи. Многим О. в твердом состоянии присущ полиморфизм.
Нек-рые О. элементов III, IV, V гр. (напр., В, Si, As, Р) образуют рентгеноаморфные
стекла. Оксиды s- и /^-элементов (напр., MgO, Аl2О3,
SiO2)-диэлектрики, О. переходных металлов (Fe, Сг и др.) часто обладают
св-вами полупроводников. Нек-рые О.-пьезоэлектрики (напр., кварц), ферромагнетики
[О. Fe, Cr(IV) и др.]. Вследствие своей многочисленности, разнообразия св-в
и доступности О. представляют исключительно важный класс неорг. в-в.
Большинство О.-солеобразующие;
при солеобразовании, протекающем обычно при нагр. (напр., Na2O +
SiO2  Na2SiO3), степени окисления элементов не изменяются. Известно
неск. несолеобразующих О. (напр., NO), не вступающих в подобные р-ции. Солеобразующие
О. подразделяют на основные, кислотные и амфотерные. Элемент основного О. (Li2O,
BaO и др.) при образовании соли (напр., ВаО + SO3
Na2SiO3), степени окисления элементов не изменяются. Известно
неск. несолеобразующих О. (напр., NO), не вступающих в подобные р-ции. Солеобразующие
О. подразделяют на основные, кислотные и амфотерные. Элемент основного О. (Li2O,
BaO и др.) при образовании соли (напр., ВаО + SO3  BaSO4) становится катионом, элемент кислотного О. (напр., SO3,
NO2, P2O5) входит в состав кислородсодержащего
аниона соли. Амфотерные О. (напр., ZnO, BeO, А12О3) могут
реагировать и как основные О., и как кислотные, напр.:
BaSO4) становится катионом, элемент кислотного О. (напр., SO3,
NO2, P2O5) входит в состав кислородсодержащего
аниона соли. Амфотерные О. (напр., ZnO, BeO, А12О3) могут
реагировать и как основные О., и как кислотные, напр.:
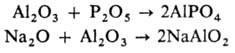
Уменьшение степени окисления
элемента и увеличение радиуса его иона делает О. более основным, наоборот, увеличение
степени окисления и уменьшение ионного радиуса-более кислотным (напр., МnО-
основной оксид, Мn2О7-кислотный). Многие О., напр. Рb3О4,
Fe3O4, содержащие элемент в разных степенях окисления,
являются двойными О.: (PbII2, PbIV)O4,
(FeII, FeIII2)O4. Среди О., особенно
среди О. d-элементов, много нестехиометрич. соединений.
О. щелочных и щел.-зем.
металлов активно реагируют с водой, образуя щелочи, напр.: К2О
+ Н2О 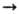 2КОН; нек-рые кислотные О. -ангидриды неорганических кислот-активно взаимод.
с водой, давая к-ты, напр.: SO3 + Н2О
2КОН; нек-рые кислотные О. -ангидриды неорганических кислот-активно взаимод.
с водой, давая к-ты, напр.: SO3 + Н2О H2SO4.
Большинство О. металлов в компактном состоянии при комнатной т-ре с водой не
реагируют. Основные О. обычно быстро реагируют с к-тами в р-ре с образованием
солей, напр.:
H2SO4.
Большинство О. металлов в компактном состоянии при комнатной т-ре с водой не
реагируют. Основные О. обычно быстро реагируют с к-тами в р-ре с образованием
солей, напр.:
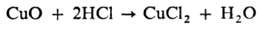
Восстановители (С, Н2,
активные металлы, в частности Mg, Al) при нагр. восстанавливают многие О. до
металла, напр.:
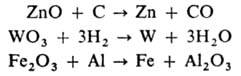
При сильном нагревании
О. с углеродом часто образуются карбиды (напр., СаО + ЗС 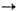 СаС2
+ СО), при хлорировании смеси О. с углем-хлориды (напр., В2О3
+ ЗС + + ЗСl2 СаС2
+ СО), при хлорировании смеси О. с углем-хлориды (напр., В2О3
+ ЗС + + ЗСl2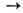 2ВСl3 + 3СО).
2ВСl3 + 3СО).
О. широко распространены
в природе. В очень больших кол-вах встречаются Н2О и SiO2.
Мн. минералы являются оксидами (гематит Fe2O3, магнетит
Fe3O4, касситерит SnO2 и др.).
Многие О. образуются при
взаимод. простых в-в с кислородом (Li2O, СаО, La2O3,
SO2 и др.). О. металлов обычно получают термич. разложением гидроксидов,
карбонатов, нитратов и др. солей кислородсодержащих к-т (напр., СаСО3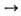 СаО + СО2), анодным окислением металлов, О. неметаллов - окислением
кислородом водородсодержащих соед. неметаллов (напр., 2H2S 4+ 3О2
СаО + СО2), анодным окислением металлов, О. неметаллов - окислением
кислородом водородсодержащих соед. неметаллов (напр., 2H2S 4+ 3О2
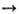 2SO2
+ 2H2O). В пром-сти в больших кол-вах получают СаО, Аl2О3,
MgO, SO3, CO, CO2, NO и другие О. Используют О. как огнеупоры
(SiO2, MgO, Al2O3 и др.), адсорбенты (SiO2-сшгака-гель,
Аl2О3 и др.), катализаторы (V2O5,
Al2O3 и др.), в произ-ве строит. материалов, стекол, фарфора,
фаянса, магн. материалов, пьезоэлектриков и др. О. металлов (Fe, Ni, Al, Sn
и др.)-сырье в произ-ве металлов, О. неметаллов (напр., S, Р, N)- в произ-ве
соответствующих к-т. 2SO2
+ 2H2O). В пром-сти в больших кол-вах получают СаО, Аl2О3,
MgO, SO3, CO, CO2, NO и другие О. Используют О. как огнеупоры
(SiO2, MgO, Al2O3 и др.), адсорбенты (SiO2-сшгака-гель,
Аl2О3 и др.), катализаторы (V2O5,
Al2O3 и др.), в произ-ве строит. материалов, стекол, фарфора,
фаянса, магн. материалов, пьезоэлектриков и др. О. металлов (Fe, Ni, Al, Sn
и др.)-сырье в произ-ве металлов, О. неметаллов (напр., S, Р, N)- в произ-ве
соответствующих к-т.
С. И. Дракин.
===
Исп. литература для статьи «ОКСИДЫ»: нет данных
Страница «ОКСИДЫ» подготовлена по материалам химической энциклопедии.
|

