|
ОСМОС (от греч.
 -толчок,
давление), самопроизвольный перенос в-ва через полупроницаемую мембрану, разделяющую
два р-ра разл. концентрации или чистый р-ритель и р-р. Наиб. часто происходит
переход р-рителя через полупроницаемую мембрану, не пропускающую растворенное
в-во. Самопроизвольный массоперенос возникает в
результате того, что хим. потенциал р-рителя уменьшается при увеличении концентрации
растворенного в-ва. -толчок,
давление), самопроизвольный перенос в-ва через полупроницаемую мембрану, разделяющую
два р-ра разл. концентрации или чистый р-ритель и р-р. Наиб. часто происходит
переход р-рителя через полупроницаемую мембрану, не пропускающую растворенное
в-во. Самопроизвольный массоперенос возникает в
результате того, что хим. потенциал р-рителя уменьшается при увеличении концентрации
растворенного в-ва.
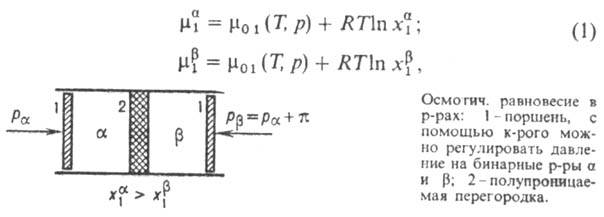
Рассмотрим два объема 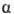 и
и 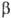 бинарного
р-ра (см. рис.), разделенных полупроницаемой перегородкой, пропускающей молекулы
р-рителя (компонент 1) и не пропускающей молекулы растворенного в-ва (компонент
2). Если т-ра T и давление р по обе стороны перегородки одинаковы
(Т бинарного
р-ра (см. рис.), разделенных полупроницаемой перегородкой, пропускающей молекулы
р-рителя (компонент 1) и не пропускающей молекулы растворенного в-ва (компонент
2). Если т-ра T и давление р по обе стороны перегородки одинаковы
(Т =
Т =
Т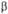 , ,
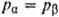 ),
а молярные доли различны ( ),
а молярные доли различны (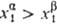 ), то
), то 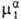 (Т, р,
(Т, р, 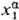 )
> )
>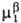 (Т,
р, (Т,
р,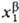 ).
Для идеальных или сильно разбавленных реальных р-ров, где ).
Для идеальных или сильно разбавленных реальных р-ров, где
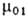 -хим.
потенциал чистого р-рителя, R-газовая постоянная. При -хим.
потенциал чистого р-рителя, R-газовая постоянная. При 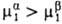 система термодинамически неравновесна и, следовательно, имеет место переход
компонента 1 из объема
система термодинамически неравновесна и, следовательно, имеет место переход
компонента 1 из объема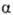 в
объем в
объем 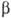 до тех пор, пока его молярные доли в обоих объемах не станут одинаковыми. Для
того чтобы предотвратить массоперенос и выравнивание концентраций и сохранить
первонач. состав обоих р-ров, необходимо выравнить хим. потенциалы компонента
1 по обе стороны перегородки изменением внеш. условий (т-ры, давления, внеш.
электрич. поля, если речь идет о р-рах электролитов). В изотермич. условиях
для сохранения состава фаз необходимо изменить давление на один из р-ров. Из
термодинамики известно, что
до тех пор, пока его молярные доли в обоих объемах не станут одинаковыми. Для
того чтобы предотвратить массоперенос и выравнивание концентраций и сохранить
первонач. состав обоих р-ров, необходимо выравнить хим. потенциалы компонента
1 по обе стороны перегородки изменением внеш. условий (т-ры, давления, внеш.
электрич. поля, если речь идет о р-рах электролитов). В изотермич. условиях
для сохранения состава фаз необходимо изменить давление на один из р-ров. Из
термодинамики известно, что

где 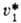 -парциальный
молярный объем р-рителя. Для идеальных или предельно разбавленных реальных р-ров -парциальный
молярный объем р-рителя. Для идеальных или предельно разбавленных реальных р-ров
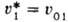 , где , где
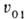 -молярный
объем чистого р-рителя. Знак производной положительный и при увеличении давления,
приложенного к р-ру -молярный
объем чистого р-рителя. Знак производной положительный и при увеличении давления,
приложенного к р-ру 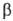 ,
хим. потенциал р-рителя будет возрастать. Дополнит. давление ,
хим. потенциал р-рителя будет возрастать. Дополнит. давление 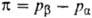 , к-рое надо приложить к р-ру
, к-рое надо приложить к р-ру 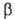 для того, чтобы предотвратить поступление в него р-рителя через полупроницаемую
мембрану из р-ра
для того, чтобы предотвратить поступление в него р-рителя через полупроницаемую
мембрану из р-ра 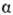 ,
наз. осмотич. давлением. При давлении ,
наз. осмотич. давлением. При давлении 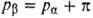 система находится в термодинамически равновесном состоянии:
система находится в термодинамически равновесном состоянии:
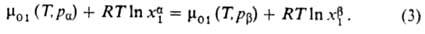
Если 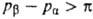 , равновесие нарушается и имеет место перенос р-рителя из более концентрир.
р-ра в менее концентрированный. Это явление получило назв. обратного осмоса;
оно находит широкое практич. применение в мембранных процессах разделения
в-в.
, равновесие нарушается и имеет место перенос р-рителя из более концентрир.
р-ра в менее концентрированный. Это явление получило назв. обратного осмоса;
оно находит широкое практич. применение в мембранных процессах разделения
в-в.
Для идеальных р-ров зависимость
осмотич. давления от состава выражается ур-нием:
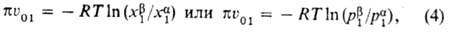
где 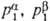 -парциальные давления р-рителя в фазах
-парциальные давления р-рителя в фазах 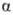 и
и 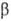 . Если
фаза . Если
фаза 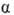 представляет собой чистый р-ритель, т.е.
представляет собой чистый р-ритель, т.е. 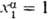 , то
, то 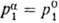 ;
ур-ние принимает вид, известный как ур-ние Ван Лаара: ;
ур-ние принимает вид, известный как ур-ние Ван Лаара:
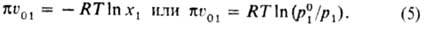
Из него следует, что осмотич.
давление р-ра пропорционально ln x1. Этой же величине
пропорциональны понижение т-ры замерзания и повышение т-ры кипения идеальных
р-ров (см. Рауля закон), что свидетельствует о связи этих явлений
с О.
Если концентрация растворенного
в-ва мила, зависимость осмотич. давления от его молярной концентрации с2
выражается ур-нием Вант-Гоффа:

Это ур-ние обычно используют
для расчета осмотич. давления бинарных р-ров недиссоциирующих в-в. Однако лучшее
совпадение расчетных значений с экспериментальными в широкой концентрац. области
дает ур-ние Ван Лаара (см. табл.). О методах и технике измерения осмотич. давления
см. Осмометрия.
===
Исп. литература для статьи «ОСМОС»: нет данных
Страница «ОСМОС» подготовлена по материалам химической энциклопедии.
|

