|
ПАРЦИАЛЬНЫЕ
МОЛЯРНЫЕ ВЕЛИЧИНЫ,
термодинамич. величины, к-рые используют для описания концентрац. зависимостей
св-в р-ров. Пусть М -нек-рая экстенсивная ф-ция состояния системы из
h компонентов, т. е. св-во, зависящее от массы
системы (объем, внутр. энергия, энтальпия, энтропия, энергия Гиббса, энергия
Гельмгольца, теплоемкость и т.п.). Для i-го компонента П.м. в. Mi-
определяется соотношением:
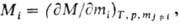
т.е. равна производной
от величины M по числу молей mi компонента i
при постоянных т-ре T, давлении p и числах молей 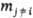 всех остальных компонентов. Так, парциальный молярный объем
всех остальных компонентов. Так, парциальный молярный объем
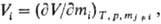
где V-объем системы;
парциальная молярная энергия Гиббса (химический потенциал)
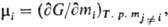
где G-энергия Гиббса системы.
П. м. в. характеризует
изменение величины M при добавлении к бесконечно большому кол-ву р-ра
1 моля компонента i в условиях постоянства T, p и чисел молей всех
остальных компонентов. Если молярная доля xi компонента равна
единице, то П.м.в. Mi обращается в молярную величину
Mm для индивидуального в-ва (напр., парциальный молярный объем
компонента - в молярный объем). Значение Mi определяется не
только природой i-го компонента, но и св-вами системы в целом, поскольку
молекулы i-го компонента взаимод. со всеми др. молекулами; в неявном
виде эта величина учитывает все изменения св-в системы при внесении i-го
компонента.
В реальном р-ре в общем
случае все П.м.в. зависят от состава, давления и т-ры. Если р-р идеальный, то
при заданных Т и p парциальные молярные объем, внутр. энергия,
энтальпия, теплоемкость во всей области концентраций постоянны и совпадают с
соответствующими молярными величинами чистых компонентов. Хим. потенциал mi
ид и парциальная молярная энтропия Si ид связаны
с соответствующими молярными величинами чистого в-ва - энергией Гиббса 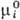 и энтропией
и энтропией 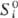 соотношениями:
соотношениями:
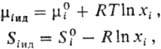
где R - газовая
постоянная.
Зависимость П.м.в. от Т
и р определяется теми же термодинамич. соотношениями, что и для соответствующих
экстенсивных св-в. Так, для хим. потенциала mi выполняются
соотношения, аналогичные тем, к-рые справедливы для энергии Гиббса, а именно:
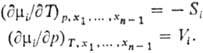
Ф-ция M для системы
в целом представляет собой сумму П.м.в. компонентов, умноженных на соответствующие
числа молей: M
= 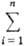 Mi
mi. B частности, энергия Гиббса системы G = Mi
mi. B частности, энергия Гиббса системы G = 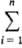 mimi. Молярное (удельное) значение
Mm =
mimi. Молярное (удельное) значение
Mm =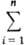 xiMi
. Зависимости молярного значения Mm от T,
р, x1
, ... , xn-1 служат для нахождения П.м.в.: xiMi
. Зависимости молярного значения Mm от T,
р, x1
, ... , xn-1 служат для нахождения П.м.в.:
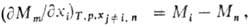
где
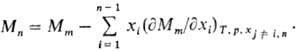
Для приближенного определения
используют графич. метод (см. рис.). В случае бинарной системы
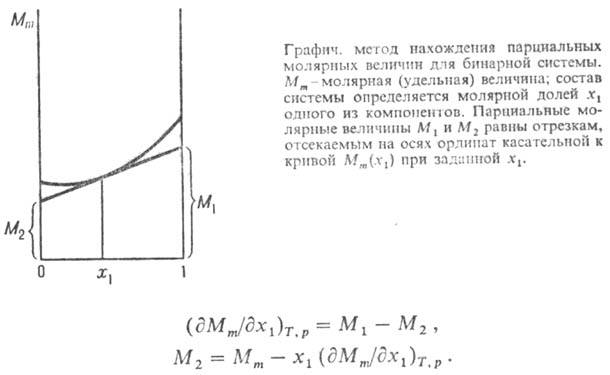
Изменения П. м. в. при
изменении состояния системы связаны между собой Гиббса-Дюгема уравнением,
к-рое в обобщенном виде записывается след. образом:
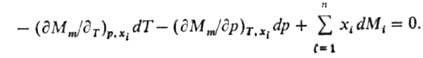
При Т, p = const
(изотермо-изобарные условия)
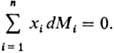
Согласно этому ур-нию,
в бинарной системе П. м. в. M1 и M2 при
изменении состава изменяются в противоположных направлениях. Экстремумы на кривых
M1(x1) и M2(x1),
если таковые имеются, наблюдаются при одном и том же составе и противоположны
по типу. Напр., для хим. потенциалов
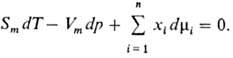 При T, p = const
При T, p = const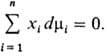
Это соотношение служит
для расчета хим. потенциала компонента р-ра на основании концентрац. зависимости
хим. потенциалов остальных компонентов, а также используется для проверки на
термодинамич. согласованность эксперим. данных о зависимостях хим. потенциалов
от состава, т-ры и т.п.
Понятие П. м. в. широко
используют при рассмотрении хим. и фазовых равновесий.
===
Исп. литература для статьи «ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ВЕЛИЧИНЫ,»: Карапетьянц
M. X., Химическая термодинамика, 3 изд., M., 1975; Физическая химия, под ред.
Б. П. Никольского, 2 изд., Л., 1987. H. А. Смирнова.
Страница «ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ВЕЛИЧИНЫ,» подготовлена по материалам химической энциклопедии.
|

