|
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ,
один из осн. законов термодинамики; является законом сохранения энергии
для систем, в к-рых существ, значение имеют тепловые процессы (поглощение или
выделение тепла). Согласно П. н. т., термодинамич. система (напр., пар в тепловой
машине) может совершать работу только за счет своей внутр. энергии или к.-л.
внеш. источника энергии. П. н. т. часто формулируют как невозможность существования
вечного двигателя первого рода, к-рый совершал бы работу, не черпая энергию
из нек-рого источника.
П. н. т. вводит представление
о внутренней энергии системы как ф-ции состояния. При сообщении системе
нек-рого кол-ва теплоты Q происходит изменение внутр. энергии системы
DU и система совершает работу А:
DU = Q + А.
П. н. т. утверждает, что
каждое состояние системы характеризуется определенным значением внутр. энергии
U, независимо от того, каким путем приведена система в данное состояние.
В отличие от значений U значения A и Q зависят от процесса,
приведшего к изменению состояния системы. Если начальное и конечное состояния
a и b бесконечно близки (переходы между такими состояниями наз.
инфи-нитезимальными процессами), П. н. т. записывается в виде:
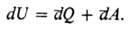
Это означает, что бесконечно
малое изменение внутр. энергии dU является полным дифференциалом ф-ции
состояния, т.е. интеграл
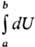 = Ub
— Ua , тогда как бесконечно малые кол-ва теплоты = Ub
— Ua , тогда как бесконечно малые кол-ва теплоты 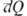 и работы
и работы 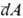 не являются дифференц. величинами, т.е. интегралы от этих бесконечно малых величин
зависят от выбранного пути перехода между состояниями а и b (иногда
их наз. неполными дифференциалами).
не являются дифференц. величинами, т.е. интегралы от этих бесконечно малых величин
зависят от выбранного пути перехода между состояниями а и b (иногда
их наз. неполными дифференциалами).
Из общего кол-ва работы,
производимой системой объема У, можно выделить работу обратимого изотермич.
расширения под действием внеш. давления pe, равную peV,
и все остальные виды работы, каждый из к-рых можно представить произведением
нек-рой обобщенной силы 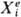 ,
действующей на систему со стороны окружающей среды, на обобщенную координату
xi , изменяющуюся под воздействием соответствующей обобщенной
силы. Для инфинитези-мального процесса ,
действующей на систему со стороны окружающей среды, на обобщенную координату
xi , изменяющуюся под воздействием соответствующей обобщенной
силы. Для инфинитези-мального процесса
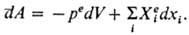
П. н. т. позволяет рассчитать
макс. работу, получаемую при изотермич. расширении идеального газа, изотермич.
испарении жидкости при пост. давлении, устанавливать законы адиабатич. расширения
газов и др. П. н. т. является основой термохимии, рассматривающей системы,
в к-рых теплота поглощается или выделяется в результате хим. р-ций, фазовых
превращ. или растворения (разбавления р-ров).
Если система обменивается
со средой не только энергией, но и в-вом (см. Открытая система), изменение
внутр. энергии системы при переходе из начального состояния в конечное включает
помимо работы А и теплоты Q еще и т. наз. энергию массы Z. Бесконечно
малое кол-во энергии массы в инфинитезимальном процессе определяется хим. потенциалами
mk каждого из компонентов системы:  =
=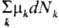 , где dNk - бесконечно малое изменение числа молей k-гo
компонента в результате обмена со средой.
, где dNk - бесконечно малое изменение числа молей k-гo
компонента в результате обмена со средой.
В случае квазистатич. процесса,
при к-ром система в каждый момент времени находится в равновесии с окружающей
средой, П. н. т. в общем виде имеет след. мат. выражение:
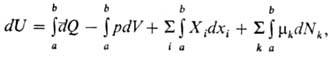
где p и mk
равны соответствующим значениям для окружающей среды (индекс е при Xi
обычно опускают). Это выражение используется в прикладной термодинамике
применительно к системам, в к-рых производится работа хим., электрич., магн.
и т.п. сил.
П. н. т. было сформулировано
в сер. 19 в. в результате работ Ю. P. Майера, Дж. Джоуля и Г. Гельмгольца. Вместе
со вторым началом термодинамики оно составляет основу классич. термодинамики.
В 60-х гг. 20 в. сформулирован фундам. закон устойчивого равновесия систем (Д.
Хацо-пулос, Д. Кинан, P. Хейвуд), следствиями к-рого являются как П. н. т.,
так и второе начало.
===
Исп. литература для статьи «ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ»: Кубо Р., Термодинамика,
пер. с англ., M., 1970; Гельфер Я. M., История и методология термодинамики и
статистической физики, 2 изд., M., 1981; Хейвуд Р., Термодинамика равновесных
процессов, пер. с англ., M., 1983; Alberty R. A., Physical chemistry, 7 ed,
N. Y., 1987. Г.П. Гладышев.
Страница «ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ» подготовлена по материалам химической энциклопедии.
|

