|
ПЕРИОДИЧЕСКАЯ
СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, упорядоченное множество хим. элементов,
их естеств. классификация, являющаяся табличным выражением периодического
закона Менделеева. Прообразом пе-риодич. системы хим. элементов (П. с.)
послужила таблица "Опыт системы элементов, основанной на их атомном весе и химическом
сходстве", составленная Д. И. Менделеевым 1 марта 1869 (рис. 1). В послед. годы
ученый совершенствовал таблицу, развил представления о периодах и группах элементов
и о месте элемента в системе. В 1870 Менделеев назвал систему естественной,
а в 1871 периодической. В результате уже тогда П. с. во многом приобрела совр.
структурные очертания. Опираясь на нее, Менделеев предсказал существование и
св-ва ок. 10 неизвестных элементов; эти прогнозы впоследствии подтвердились.
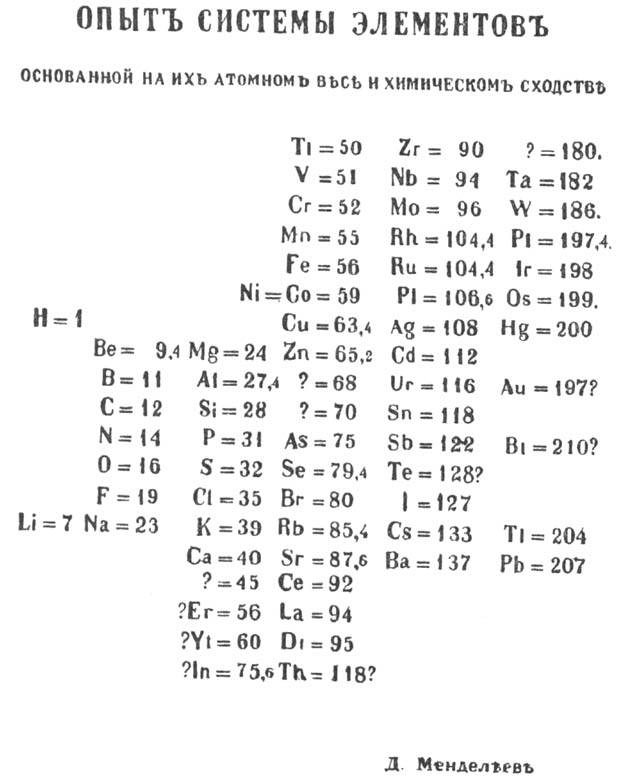
Рис. 1 Таблица "Опыт
системы элементов, основанной на их атомном весе и химическом сходстве"
(Д. И. Менделеев. I мирта 1869).
Однако на протяжении последующих
более 40 лет П. с. в значит. степени представляла собой лишь эмпирич. обобщение
фактов, поскольку отсутствовало физ. объяснение причин периодич. изменения CB-B
элементов в зависимости от возрастания их атомной массы. Такое объяснение было
невозможно без обоснованных представлений о строении атома (см. Атом).
Поэтому важнейшей вехой в развитии П. с. стала планетарная (ядерная) модель
атома, предложенная Э. Резерфордом (1911). В 1913 А. ван ден Брук пришел к выводу,
что порядковый номер элемента в П. с. численно равен положит. заряду (Z) ядра
его атома. Этот вывод был экспериментально подтвержден Г. Мозли (закон Мозли,
1913-14). В результате периодич. закон получил строгую физ. формулировку, удалось
однозначно определить ниж. границу П.с. (H как элемент с миним. Z=1), оценить
точное число элементов между H и U и установить, какие элементы
еще не открыты (Z = 43, 61, 72, 75, 85, 87). Теория П. с. была разработана в
нач. 1920-х гг. (см. ниже).
Структура П. с. Современная
П. с. включает 109 хим элементов (имеются сведения о синтезе в 1988 элемента
с Z=110). Из них в прир. объектах обнаружены 89; все элементы, следующие за
U, или трансурановые элементы (Z = 93 109), а также Tc (Z = 43), Pm (Z = 61)
и At (Z = 85) были искусственно синтезированы с помощью разл. ядерных реакций.
Элементы с Z= 106 109 пока не получили названий, поэтому соответствующие
им символы в таблицах отсутствуют; для элемента с Z = 109 еще неизвестны массовые
числа наиб. долгоживущих изотопов.
За всю историю П. с. было
опубликовано более 500 разл вариантов ее изображения. Это обусловливалось попытками
отыскать рациональное решение нек-рых спорных проблем структуры П. с. (размещение
H, благородных газов, ланта-ноидов и трансурановых элементов и т.п.). Наиб.
распространение получили след. табличные формы выражения П. с.: 1) короткая
предложена Менделеевым (в совр. виде помещена в начале тома на цветном форзаце);
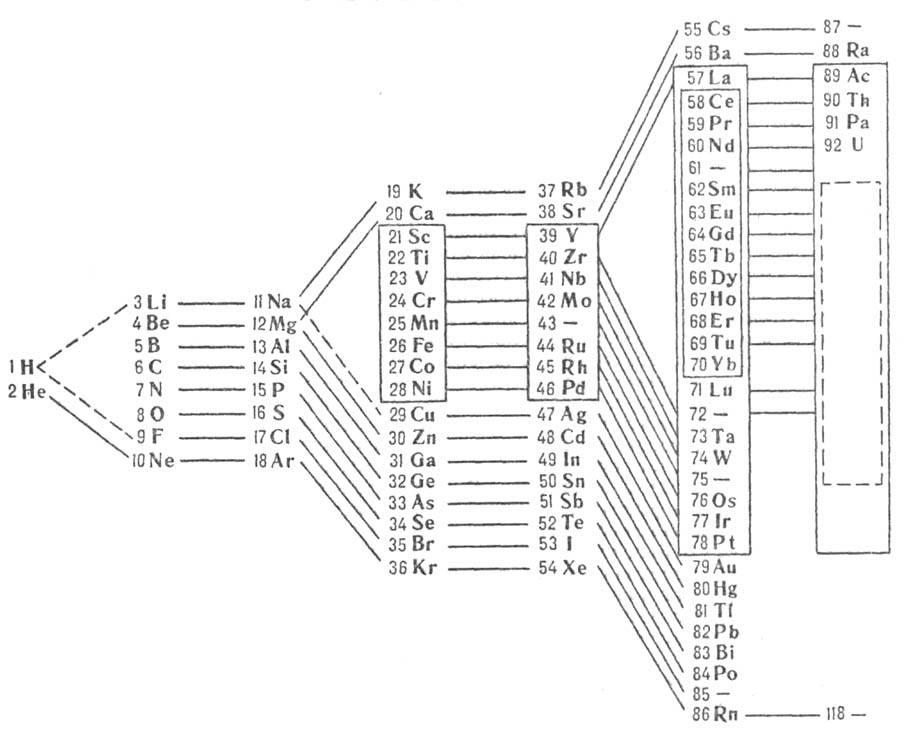
2) длинная разрабатывалась Менделеевым, усовершенствована в 1905 А. Вернером
(рис.2); 3) лестничная опубликована в 1921 H. Бором (рис. 3). В последние десятилетия
особенно широко используются короткая и длинная формы, как наглядные и практически
удобные. Все перечисл. формы имеют определенные достоинства и недостатки. Однако
едва ли можно предложить к.-л. универс. вариант изображения П. с., к-рый адекватно
отразил бы все многообразие св-в хим. элементов и специфику изменения их хим.
поведения по мере возрастания Z.
Фундам. принцип построения
П. с. заключается в выделении в ней периодов (горизонтальные ряды) и групп (вертикальные
столбцы) элементов. Современная П. с. состоит из 7 периодов (седьмой, пока не
завершенный, должен заканчиваться гипотетич. элементом с Z= 118) и 8 групп Периодом
наз. совокупность элементов, начинающаяся щелочным металлом (или водородом первый
период) и заканчивающаяся благородным газом. Числа элементов в периодах закономерно
возрастают и, начиная со второго, попарно повторяются: 8, 8, 18, 18, 32, 32,
... (особый случай первый период, содержащий всего два элемента). Группа элементов
не имеет четкой дефиниции; формально ее номер соответствует макс. значению степени
окисления составляющих ее элементов, но это условие в ряде случаев не выполняется.
Каждая группа подразделяется на главную (а)и побочную (б)подгруппы;
в каждой из них содержатся элементы, сходные по хим. св-вам, атомы к-рых характеризуются
одинаковым строением внеш. электронных оболочек. В большинстве групп элементы
подгрупп а и б обнаруживают определенное хим. сходство, преим.
в высших степенях окисления.
Особое место в структуре
П. с. занимает группа VIII. На протяжении длит. времени к ней относили только
элементы "триад": Fe-Co-Ni и платиновые металлы (Ru Rh Pd и Os-Ir-Pt),
а все благородные газы располагали в самостоят. нулевой группе; следовательно,
П. с. содержала 9 групп. После того как в 60-х гг. были получены соед. Xe, Kr
и Rn, благородные газы стали размещать в подгруппе VIIIa, а нулевую группу упразднили.
Элементы же триад составили подгруппу VIII6. Такое "структурное
оформление" группы VIII фигурирует ныне практически во всех публикуемых
вариантах выражения П. с.
Отличит. черта первого
периода состоит в том, что он содержит всего 2 элемента: H и Не. Водород вследствие
специфичности св-в - единств. элемент, не имеющий четко определенного места
в П. с. Символ H помещают либо в подгруппу Ia, либо в подгруппу VIIa, либо в
обе одновременно, заключая в одной из подгрупп символ в скобки, или, наконец,
изображая его разл. шрифтами. Эти способы расположения H основаны на том, что
он имеет нек-рые формальные черты сходства как со щелочными металлами, так и
с галогенами.
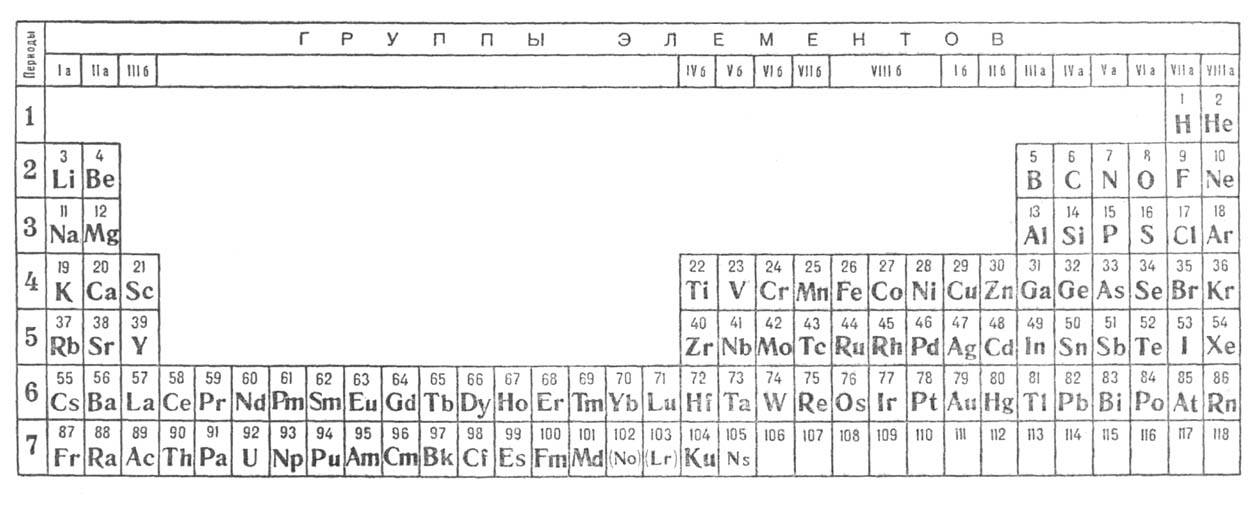
Рис. 2. Длинная форма периодич.
системы хим. элементов (совр. вариант). Рис. 3. Лестничная форма периодич. системы
хим. элементов (H. Бор, 1921).
Второй период (Li-Ne),
содержащий 8 элементов, начинается щелочным металлом Li (единств, степень окисления
+ 1); за ним следует металл Be (степень окисления + 2). Металлич. характер
В (степень окисления +3) выражен слабо, а следующий за ним С - типичный неметалл
(степень окисления +4). Последующие N, О, F и Ne-неметаллы, причем только у
N высшая степень окисления + 5 отвечает номеру группы; О и F относятся к числу
самых активных неметаллов.
Третий период (Na-Ar) также
включает 8 элементов, характер изменения хим. св-в к-рых во многом аналогичен
наблюдающемуся во втором периоде. Однако Mg и Al более "металлич-ны",
чем соотв. Be и В. Остальные элементы-Si, P, S, Cl и Ar-неметаллы; все они проявляют
степени окисления, равные номеру группы, кроме Ar. T. обр.,
во втором и третьем периодах по мере увеличения Z наблюдается ослабление металлического
и усиление неметаллич. характера элементов.
Все элементы первых трех
периодов относятся к подгруппам а. По совр. терминологии, элементы, принадлежащие
к подгруппам Ia и IIa, наз. I-элементами (в цветной таблице их символы даны
красным цветом), к подгруппам IIIa-VIIIa-р-элементами (символы
оранжевого цвета).
Четвертый период (K-Kr)
содержит 18 элементов. После щелочного металла К и щел.-зем. Ca (s-элементы)
следует ряд из 10 т. наз. переходных (Sc-Zn), или d-элементов (символы
синего цвета), к-рые входят в подгруппы б. Большинство переходных элементов
(все они - металлы) проявляют высшие степени окисления, равные номеру группы,
исключая триаду Fe-Co-Ni, где Fe в определенных условиях имеет степень окисления
+6, а Со и Ni максимально трехвалентны. Элементы от Ga до Kr относятся к подгруппам
a (р-элементы), и характер изменения их св-в во многом подобен изменению
св-в элементов второго и третьего периодов в соответствующих интервалах значений
Z. Для Kr получено неск. относительно устойчивых соед., в осн. с F.
Пятый период (Rb-Xe) построен
аналогично четвертому; в нем также имеется вставка из 10 переходных, или d-элементов
(Y-Cd). Особенности изменения св-в элементов в периоде: 1) в триаде Ru-Rh-Pd
рутений проявляет макс, степень окисления 4- 8; 2) все элементы подгрупп а,
включая Xe, проявляют высшие степени окисления, равные номеру группы; 3) у I
отмечаются слабые металлич. св-ва. T. обр., св-ва элементов четвертого и пятого
периодов по мере увеличения Z изменяются сложнее, чем св-ва элементов во втором
и третьем периодах, что, в первую очередь, обусловлено наличием переходных d-элементов.
Шестой период (Cs-Rn) содержит
32 элемента. В него помимо десяти d-элементов (La, Hf-Hg) входит семейство
из 14 f-элементов (символы черного цвета, от Ce до Lu)-лaнтaнoидoв. Они
очень похожи по хим. св-вам (преим. в степени окисления +3) и поэтому не м.
б. размещены по разл. группам системы. В короткой форме П. с. все ланта-ноиды
включены в подгруппу IIIa (клетка La), а их совокупность расшифрована
под таблицей. Этот прием не лишен недостатков, поскольку 14 элементов как бы
оказываются вне системы.
В длинной и лестничной формах П. с. специ-фика лантаноидов отражается на общем
фоне ее структуры. Др. особенности элементов периода: 1) в триаде Os Ir Pt только
Os проявляет макс. степень окисления +8; 2) At имеет более выраженный по сравнению
с I металлич. характер; 3) Rn наиб. реакционноспособен из благородных газов,
однако сильная радиоактивность затрудняет изучение его хим. св-в.
Седьмой период подобно
шестому должен содержать 32 элемента, но еще не завершен. Fr и Ra элементы соотв.
подгрупп Ia и IIa, Ac аналог элементов подгруппы III6. Согласно
актинидной концепции Г. Сиборга (1944), после Ac следует семейство из 14 f-элементов
актиноидов (Z = 90 103). В короткой форме П. с. последние включаются
в клетку Ac и подобно лантаноидам записываются отд. строкой под таблицей. Этот
прием предполагал наличие определенного хим. сходства элементов двух f-семейств.
Однако детальное изучение химии актиноидов показало, что они проявляют гораздо
более широкий диапазон степеней окисления, в т. ч. и таких, как +7 (Np, Pu,
Am). Кроме того, для тяжелых актиноидов характерна стабилизация низших степеней
окисления ( + 2 или даже +1 для Md).
Оценка хим. природы Ku
(Z = 104) и Ns (Z = 105), синтезированных в кол-ве единичных весьма короткоживущих
атомов, позволила сделать вывод, что эти элементы аналоги соотв. Hf и Та, т.
е. d-элементы, и должны располагаться в подгруппах IV6 и V6.
Хим. идентификация элементов с Z= 106 109 не проводилась, но можно предполагать,
что они относятся к переходным элементам седьмого периода. Расчеты с помощью
ЭВМ свидетельствуют о принадлежности элементов с Z = 113 118 к p-элементам
(подгруппы IIIa VIIIa).
Теория П. с. была
преим. создана H. Бором (1913 21) на базе предложенной им квантовой модели атома.
Учитывая специфику изменения св-в элементов в П. с. и сведения об их атомных
спектрах, Бор разработал схему построения электронных конфигураций атомов по
мере возрастания Z, положив ее в основу объяснения явления периодичности и структуры
П. с. Эта схема опирается на определенную последовательность заполнения электронами
оболочек (наз. также слоями, уровнями) и подоболочек (оболочек, подуровней)
в атомах в соответствии с увеличением Z. Сходные электронные конфигурации внеш.
электронных оболочек в атомах периодически повторяются, что и обусловливает
периодич. изменение хим. св-в элементов. В этом состоит гл. причина физ. природы
феномена периодичности. Электронные оболочки, за исключением тех, к-рые отвечают
значениям 1 и 2 главного квантового чиела л, не заполняются последовательно
и монотонно до своего полного завершения (числа электронов в последоват. оболочках
составляют: 2, 8, 18, 32, 50,...); построение их периодически прерывается появлением
совокупностей электронов (составляющих определенные подоболочки), к-рые отвечают
большим значениям п. В этом заключается существ. особенность "электронного"
истолкования структуры П. с.
Схема формирования электронных
конфигураций атомов, лежащая в основе теории П. с., отражает, т. обр., определенную
последовательность появления в атомах по мере роста Z совокупностей электронов
(подоболочек), характеризующихся нек-рыми значениями главного и орбитального
(l) квантовых чисел. Данная схема в общем виде записывается в виде табл.
(см. ниже).
Вертикальными чертами разделены
подоболочки, к-рые заполняются в атомах элементов, составляющих последоват.
периоды П. с. (номера периодов обозначены цифрами сверху); жирным шрифтом выделены
подоболочки, завершающие формирование оболочек с данным п.
Числа электронов в оболочках
и подоболочках определяются на основании Паули принципа. Применительно
к электронам, как частицам с полуцелым спином, он постулирует, что в атоме не
м. б. двух электронов с одинаковыми значениями всех квантовых чисел. Емкости
оболочек и подоболочек равны соотв. 2п2 и 2(2l + 1).
Этот принцип не определяет.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Число электронов
в подобо-лочке
|
|
|
|
|
|
|
|
|
|
|
Число элементов
в периоде
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
однако, последовательность
формирования электронных конфигураций атомов по мере возрастания Z. Из приведенной
выше схемы находятся емкости последоват. периодов: 2, 8, 18, 32, 32, ....
Каждый период начинается
элементом, в атоме к-рого впервые появляется электрон с данным значением n
при l = 0 (ns1-элементы), и заканчивается элементом,
в атоме к-рого заполнена подоболочка с тем же n и l = 1 (np6-элемен-ты);
исключение-первый период (только 1s-элементы). Все s- и p-
элементы принадлежат к подгруппам а. К подгруппам б относятся
элементы, в атомах к-рых достраиваются оболочки, ранее оставшиеся недостроенными
(значения h меньше номера периода, l = 2 и 3). В первые три
периода входят элементы только подгрупп а, т. е. s- и р-элементы.
Реальная схема построения
электронных конфигураций атомов описывается т. наз. (п + l)-правилом,
сформулированным (1951) В. M. Клечковским. Построение электронных конфигураций
происходит в соответствии с последоват увеличением суммы (п + /). При
этом в пределах каждой такой суммы сначала заполняются подоболочки с большими
l и меньшими n, затем с меньшими l и большими п.
Начиная с шестого периода
построение электронных конфигураций атомов в действительности приобретает более
сложный характер, что выражается в нарушении четких границ между последовательно
заполняющимися подобо-лочками. Напр., 4f-электрон появляется не в атоме
La с Z = 57, а в атоме следующего за ним Ce (Z = 58); последоват. построение
4f-подоболочки прерывается в атоме Gd (Z = 64, наличие 5d-электрона).
Подобное "размывание периодичности" отчетливо сказывается в седьмом
периоде для атомов с Z > 89, что отражается на св-вах элементов.
Реальная схема первоначально
не была выведена из к.-л. строгих теоретич. представлений. Она основывалась
на известных хим. св-вах элементов и сведениях об их спектрах. Действит. физ.
обоснование реальная схема получила благодаря применению методов квантовой механики
к описанию строения атомов. В квантовомех. интерпретации теории строения атомов
понятие электронных оболочек и подоболочек при строгом подходе утратило свой
исходный смысл; ныне широко используется представление об атомных орбиталях.
Тем не менее разработанный Бором принцип физ. интерпретации явления периодичности
не потерял своего значения и в первом приближении достаточно исчерпывающе объясняет
теоретич. основы П. с. Во всяком случае, в публикуемых формах изображения П.
с. отражается представление о характере распределения электронов по оболочкам
и подоболочкам.
Строение атома и химические
свойства элементов. Осн особенности хим. поведения элементов определяются
характером конфигураций внешних (одной-двух) электронных оболочек атомов. Эти
особенности различны для элементов подгрупп a (s- и p-элементов),
подгрупп б (d-элементы), f-семейств (лантаноиды и актиноиды).
Особое место занимают 1s-элементы
первого периода (H и Не). Водород вследствие присутствия в атоме только одного
электрона отличается большой специфичностью св-в.
Исключительной прочностью характеризуется конфигурация атома Не (1s2),
что обусловливает его хим. инертность. Поскольку у элементов подгрупп а
происходит заполнение внеш. электронных оболочек (с n, равным номеру
периода), св-ва элементов заметно изменяются по мере возрастания Z в соответствующих
периодах, что выражается в ослаблении металлических и усилении неметаллич. св-в.
Все неметаллы, кроме H и Не,-p-элементы. В то же время в каждой подгруппе
а по мере увеличения Z наблюдается усиление металлич. св-в. Эти закономерности
объясняются ослаблением энергии связи внеш. электронов с ядром при переходе
от периода к периоду.
В атомах переходных d-элементов
подгрупп б достраиваются незавершенные оболочки с n, на единицу
меньше номера периода. Конфигурация внеш. оболочек у них, как правило, ns2;
все d-элементы металлы. Аналогичная структура внеш. оболочки d-элементов
в каждом периоде приводит к тому, что изменение их св-в по мере возрастания
Z не происходит резко. Четкое различие проявляется в случае высших степеней
окисления, при к-рых d-элементы обнаруживают определенное сходство с
р-элементами соответствующих групп П. с.
Для большинства атомов
лантаноидов характерна электронная конфигурация внеш. оболочек 4f n6s2
; однако в атомах Ce и Gd содержится 5d-электрон. Подоболочка 4f
завершается в атоме Yb (Z = 70), а у следующего Lu (Z = 71) начинается систематич.
заполнение 5d-подоболочки, т.е. фактически Lu относится к d-элементам.
Эти особенности построения реальной схемы в интервале Z = 57-71 заключаются,
в частности, в том, что для нек-рых лантаноидов известны степени окисления,
отличные от +3, напр. +4 для Ce, Pr, Tb и +2 для Sm, Eu и Yb. Тем не менее преобладающей
и наиб. стабильной оказывается степень окисления +3, что и определяет большое
хим. сходство лантана и лантаноидов. Эта степень окисления реализуется за счет
двух 6.у-электронов и одного из электронов 4f-подоболочки (в атомах Ce
и Gd принимает участие 5d-электрон). В области Z = 57-71 впервые отмечается
"размывание периодичности", т.е. нарушение порядка заполнения соседних
последовательных электронных подоболочек, что объясняется близостью энергий
связи 5d- и 4f-электронов.
Более резко "размывание
периодичности" проявляется в области актиноидов (Z = 90-103), что обусловлено
еще большей близостью энергий связи 5f- и 6d-электронов. В результате
элементы первой половины ряда способны проявлять высокие степени окисления (до
+7); с др. стороны, специфические энергетич. закономерности способствуют аномально
высокой устойчивости низших степеней окисления (+2 и +1) у нек-рых представителей
второй половины ряда актиноидов. В степени окисления + 3 сходство актиноидов
и лантаноидов несомненно, что, в частности, было широко использовано при хим.
идентификации синтезир. актиноидов. Однако этот фактор не может считаться определяющим
при сопоставлении характера хим. поведения элементов двух f-семейств.
В целом химия актиноидов существенно богаче и разнообразнее, чем химия лантаноидов,
а закономерности изменения св-в актиноидов по мере роста Z весьма специфичны.
Семейство актиноидов завершается
Lr (Z = 103, электронная конфигурация внеш. оболочек Sf 146d17s2),
к-рый подобно Lu должен быть d-элементом; с Lr начинается систематич.
заполнение 6d-подоболочки. Ориентировочная экспе-рим. оценка св-в следующего
Ku и Ns дает основания рассматривать их в качестве 6d-элементов, но вопрос
об их реальной хим. природе нельзя считать решенным, поскольку соответствующие
исследования проводились на единичных атомах. Наряду с этим расчеты на ЭВМ показали,
что, напр., для Ku вероятна электронная конфигурация внеш. оболочек атома в
осн. состоянии 7s27p2 Если это в действительности
так, то Ku, скорее, следовало бы считать аналогом Pb.
Все известные сейчас трансурановые
элементы получены искусственно и в природе не встречаются (обнаружены лишь следы
Np и Pu, отдельные изотопы к-рых образуются в результате прир. ядерных реакций).
Изотопы -элементов с Z 102 характеризуются настолько малой продолжительностью жизни, что не м.б. накоплены
даже в самых не-значит. кол-вах. Это существенно затрудняет изучение их св-в.
102 характеризуются настолько малой продолжительностью жизни, что не м.б. накоплены
даже в самых не-значит. кол-вах. Это существенно затрудняет изучение их св-в.
Нерешенные проблемы П.
с. Главная из них заключается в неопределенности верх. границы П. с. Теоретич.
оценки предельного значения Z неоднозначны и противоречивы. Допустимо, что верх.
граница определяется пределом синтеза элементов. Ныне он доведен до Z=110, но
дальнейшие перспективы пока неясны.
В сер. 60-х гг. учеными
США и СССР была выдвинута гипотеза о существовании в области больших значений
Z т. наз. островков относительной стабильности нуклидов. В соответствии с ней
гипотетич. нуклиды. отвечающие "магическим" значениям Z = 110, 114,
126 и 164 или N = 184 (N = число нейтронов), должны быть достаточно
долго-живущими (относительно стабильными) по отношению к спонтанному делению
(см. Радиоактивность, Ядро атомное). До настоящего времени эта гипотеза
не нашла подтверждения. Попытки обнаружения в природе нек-рых из подобных нуклидов
успеха не имели; эксперименты по их синтезу пока не дали положит. результатов.
Однако эти попытки стимулировали проведение расчетов на ЭВМ электронных конфигураций
осн. состояний атомов и оценку наиб. важных хим. св-в элементов в интервале
Z = 104-172. Полученные данные позволяют предполагать, что в этой области значений
Z изменение св-в элементов носило бы весьма сложный характер, не имеющий прецедентов
в предшествующих областях П.с., т.е. происходило бы резко выраженное "размывание
периодичности".
При больших значениях Z,
т.е. при наличии в атомах большого числа электронов, энергии последних на заполняющихся
внеш. подоболочках имеют близкие значения. Поэтому четкая последовательность
заполнения подоболочек нарушается (в ряде случаев весьма существенно), что неизбежно
должно отразиться на св-вах соответствующих элементов. В связи с этим структура
П. с. для Z> 118 в настоящее время не м.б. предсказана с достаточной точностью.
Только успешный синтез к.-л. из гипотетич. элементов и оценка их хим. св-в смогут
внести определенную ясность в данную проблему. Пока неизвестно конечное число
элементов, охватываемых П. с., нельзя составить полного представления о характере
и закономерностях феномена периодичности (во всем возможном интервале Z).
Выше в общих чертах были
объяснены причины и особенности периодич. изменения св-в известных элементов
по мере роста Z. Это объяснение базируется на анализе закономерностей реальной
схемы формирования электронных конфигураций своб. атомов в осн. состоянии. Однако
в ряде случаев знание электронной конфигурации своб. атома не позволяет однозначно
судить о важнейших хим. св-вах, к-рые должен проявлять тот или иной элемент.
Поэтому принцип периодического повторения (по мере возрастания Z) сходных типов
электронных конфигураций прежде всего лежит в основе периодич. системы своб.
атомов. Что касается П. с., то она отражает закономерное изменение св-в элементов,
проявляемых ими при хим. взаимодействиях, в ходе к-рых перестраиваются (иногда
значительно) конфигурации реагирующих атомов. Вследствие этою строгое количеств.
объяснение всей специфики проявления хим. элементами св-в и периодического их
изменения оказывается чрезвычайно сложной задачей, к-рая решается в русле совр.
методов квантовой механики.
Значение П. с. Эта система
сыграла и продолжает играть огромную роль в развитии мн. естественнонауч. дисциплин.
Она стала важным звеном в эволюции атомно-мол. учения, способствовала формулировке
совр. понятия "хим. элемент" и уточнению представлений о простых
в-вах и соед., оказала значит. влияние на разработку теории строения атомов
и возникновение понятия изотопии. С П. с. связана строго науч. постановка проблемы
прогнозирования в химии, что проявилось
как в предсказании существования неизвестных элементов и их св-в, так и новых
особенностей хим. поведения уже открытых элементов. П.с.- важнейшая основа неорг.
химии; она служит, напр., задачам синтеза в-в с заранее заданными св-вами, созданию
новых материалов, в частности полупроводниковых, подбору специфич. катализаторов
для разл. хим. процессов. П.с.-науч. база преподавания общей и неорг. химии,
а также нек-рых разделов атомной физики.
===
Исп. литература для статьи «ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ»: Менделеев
Д. И., Периодический закон. Основные статьи, M., 1958; Кедров Б. M.. Три аспекта
атомистики, ч. 3. Закон Менделеева, M., 1969; Трифонов Д H., О количественной
интерпретации периодичности, M., 1971; Трифонов Д. H., Кривомазов A. H., Лисневский
Ю. И., Учение о периодичности и учение о радиоактивности. Коммешированная хронология
важнейших событий. M., 1974; Карапетьями MX. Дракии С. И., Строение вещества,
M., 1978; Учение о периодичности. История и современность. Сб. статей. M.. 1981.
Корольков Д. В., Основы неорганической химии, M., 1982; Мельников В. П., Дмитриев
И С . Дополнительные виды периодичности в периодической системе Д. И. Менделеева,
М. 1988. Д. Н Трифонов.
Страница «ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ» подготовлена по материалам химической энциклопедии.
|

