|
ПЕРМАНГАНАТОМЕТРИЯ,
титриметрич. метод анализа, основанный на р-циях: 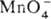 + 8H+ + 5е
+ 8H+ + 5е 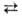 4H2O + Mn2+ и
4H2O + Mn2+ и 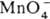 + 4H2O + Зе
+ 4H2O + Зе 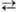 MnO2 + 4OH— (стандартные электродные потенциалы
соотв. +1,52 и +0,57 В). Титрантом служит водный р-р KMnO4, к-рый
в чистом виде очень устойчив и долго хранится. Однако в присут. Mn(II) происходит
р-ция:
MnO2 + 4OH— (стандартные электродные потенциалы
соотв. +1,52 и +0,57 В). Титрантом служит водный р-р KMnO4, к-рый
в чистом виде очень устойчив и долго хранится. Однако в присут. Mn(II) происходит
р-ция: 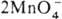 + 3Mn2+ + 2H2O
+ 3Mn2+ + 2H2O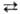 5MnO2
+ 4H+, к-рая ускоряется диоксидом марганца и при понижении кислотности
р-ра. Поскольку перманганат калия всегда содержит трудно удаляемые примеси,
свежеприготовленный р-р KMnO4 кипятят в течение часа, фильтруют через
стеклянный фильтр и хранят в темных склянках, в защищенных от прямого солнечного
света местах (т.к. на свету ускоряется разложение KMnO4 на MnO2
и O2). 5MnO2
+ 4H+, к-рая ускоряется диоксидом марганца и при понижении кислотности
р-ра. Поскольку перманганат калия всегда содержит трудно удаляемые примеси,
свежеприготовленный р-р KMnO4 кипятят в течение часа, фильтруют через
стеклянный фильтр и хранят в темных склянках, в защищенных от прямого солнечного
света местах (т.к. на свету ускоряется разложение KMnO4 на MnO2
и O2).
Для определения концентрации
титранта используют р-ры с точно известным содержанием (стандартные р-ры) Na2C2O4,
As2O3 (в присут. ICl или KIO3 в качестве катализатора),
FeS04·(NH4)2SO4·6H2O
и K4[Fe(CN)6]·3H2O. Конечную точку титрования
в П. устанавливают обычно визуально без индикатора по появлению или исчезновению
окраски перманганат-иона (даже 2·10-6 M р-р KMnO4 имеет
отчетливую розовую окраску), потенциометрически или амперометрически. При обратном
титровании к исследуемому р-ру приливают р-р KMnO4, избыток к-рого
от-титровывают р-ром восстановителя, напр. щавелевой к-ты.
П. применяют для определения
Fe(II), Sb(III), Mn(II), V(IV), W(V), U(IV), Tl(I), Cr(III), H2O2,
H2C2O4 и ее солей, арсенитов, гидразина и ряда
орг. в-в (напр., хлоруксусной и пропионовой к-т в щелочной среде); обратным
пермангана-тометрич. титрованием определяют восстановители, медленно реагирующие
с KMnO4, - иодиды, цианиды, родани-ды, фосфиты.
П. используют также для
косвенных определений. Напр., концентрации очень сильных восстановителей, окисляющихся
в обычных условиях растворенным кислородом, - Cr (II), V(II), Ti(III), Nb(III),
Mo(III), Cu(I), Sn(II) и др. - устанавливают после их взаимод. с ионами Fe(III)
по кол-ву образовавшихся ионов Fe (II), к-рые оттитровывают р-ром KMnO4.
Ионы таких металлов, как Ca, Cd, Zn, Pb(Il), Со, Ni, РЗЭ, определяют после их
осаждения в виде оксалатов. К П. часто относят обратное ферриметрич. титрование,
в к-ром при определении окислителей (дихроматов, персульфатов, ванадатов, MnO2,
PbO2, Pb3O4 и др.) их предварительно восстанавливают
с помощью Fe(II), избыток к-рого оттитровывают р-ром KMnO4.
===
Исп. литература для статьи «ПЕРМАНГАНАТОМЕТРИЯ»: Объемный анализ,
пер. с англ., т. 3, M., 1961, с. 41-72; Лайти-нен Г. А., Харрис В. E.,
Химический анализ, пер. с англ., 2 изд., M., 1979.
Г. В. Прохорова.
Страница «ПЕРМАНГАНАТОМЕТРИЯ» подготовлена по материалам химической энциклопедии.
|

