|
ПЕРХЛОРАТЫ, соед.,
содержащие тетраэдрич. группировку ClO4. Условно различают ионные,
ковалентные и координационные П. В ионных П.-солях HClO4-группа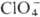 отрицательно заряжена (заряд —1). К ним относятся П. щелочных и щел.-зем. металлов,
а также мол. катионов типа
отрицательно заряжена (заряд —1). К ним относятся П. щелочных и щел.-зем. металлов,
а также мол. катионов типа  , ,
 , [M(H2O)n]+
и др. В ковалентных П. группа ClO4 связана с остальной частью молекулы
ковалентной связью через атом кислорода (R—О—ClO3), она имеет структуру
тригональной пирамиды, ее заряд меньше 1 (по абс. величине). К ковалентным П.
относятся хлорная к-та, ее ангидрид Cl2O7 и эфиры, П.
галогенов. В большинстве П. переходных и непереходных металлов (кроме щелочных
и щел.-зем.) группа ClO4 связана с атомом металла частично ковалентной
координац. связью через один, два или три атома О, будучи соотв. моно-, би-
и тридентатным лиган-дом. Характерное св-во таких П.-способность образовывать
координационные П. анионного типа , [M(H2O)n]+
и др. В ковалентных П. группа ClO4 связана с остальной частью молекулы
ковалентной связью через атом кислорода (R—О—ClO3), она имеет структуру
тригональной пирамиды, ее заряд меньше 1 (по абс. величине). К ковалентным П.
относятся хлорная к-та, ее ангидрид Cl2O7 и эфиры, П.
галогенов. В большинстве П. переходных и непереходных металлов (кроме щелочных
и щел.-зем.) группа ClO4 связана с атомом металла частично ковалентной
координац. связью через один, два или три атома О, будучи соотв. моно-, би-
и тридентатным лиган-дом. Характерное св-во таких П.-способность образовывать
координационные П. анионного типа 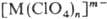 , где n= 2 — 8. Границы между группами П. нестрогие; напр., П. бора,
Si, I, большинства металлов (кроме щелочных и щел.-зем.) можно отнести и к ковалентным
и к координационным, а П. серебра, Pb, Sc и РЗЭ - и к координационным, и к ионным.
, где n= 2 — 8. Границы между группами П. нестрогие; напр., П. бора,
Si, I, большинства металлов (кроме щелочных и щел.-зем.) можно отнести и к ковалентным
и к координационным, а П. серебра, Pb, Sc и РЗЭ - и к координационным, и к ионным.
Сродство к электрону радикала
ClO4 очень высокое (5,82 эВ). Радиус иона 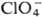 0,236 нм,
0,236 нм, 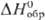 в газе -355,6 кДж/моль, а в разб. водном р-ре —129,16 кДж/моль. Распад всех
П. экзотермичен.
в газе -355,6 кДж/моль, а в разб. водном р-ре —129,16 кДж/моль. Распад всех
П. экзотермичен.
Хлорная кислота H—О—ClO3-бесцв.
летучая жидкость, сильно дымящая на воздухе, в парах мономерна; длины связей
Cl—ОН 0,1635 нм, Cl=O 0,1408 нм, О—H 0,098 нм, углы OClO 112,8°, HOClO 106,2°.
Т.пл. -101 0C, т.кип. 106 0C (с разл.); плотн. 1,7608
г/см3; ур-ние температурной зависимости давления пара lg p (мм
рт. ст.) = 8,175 — 2007/T, 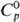 120,5 Дж/(моль·К);
120,5 Дж/(моль·К); 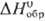 : -40,4 кДж/моль,
: -40,4 кДж/моль,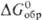 -78,5 кДж/моль;
-78,5 кДж/моль; 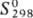 188,4 Дж/(моль·К); r 1,351·102 Ом·см; e 118 (298 К); h
0,795·10-3 Па·с. Жидкая HClO4 частично димеризована, для
нее характерна равновесная автодегидратация:
188,4 Дж/(моль·К); r 1,351·102 Ом·см; e 118 (298 К); h
0,795·10-3 Па·с. Жидкая HClO4 частично димеризована, для
нее характерна равновесная автодегидратация:
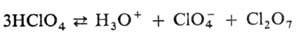
При 25 0C константа
равновесия К 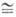 0,7·10-6.
Если пары HClO4 сконденсировать ниже 0 0C, равновесие
устанавливается в течение неск. часов. Присутствие небольшой равновесной концентрации
Cl2O7 (~0,16 M) определяет низкую термич. стабильность
жидкой HClO4; в парах, где равновесие полностью сдвинуто влево, распад
идет при 200-350 0C, в жидкой фазе-при 57-77 0C. Пар над
100%-ной HClO4 содержит 11 мол. % Cl2O7 и 89%
HClO4. Продукты термич. разложения хлорной к-ты-O2, Cl2,
ClO2, Cl2O6, HClO4 0,7·10-6.
Если пары HClO4 сконденсировать ниже 0 0C, равновесие
устанавливается в течение неск. часов. Присутствие небольшой равновесной концентрации
Cl2O7 (~0,16 M) определяет низкую термич. стабильность
жидкой HClO4; в парах, где равновесие полностью сдвинуто влево, распад
идет при 200-350 0C, в жидкой фазе-при 57-77 0C. Пар над
100%-ной HClO4 содержит 11 мол. % Cl2O7 и 89%
HClO4. Продукты термич. разложения хлорной к-ты-O2, Cl2,
ClO2, Cl2O6, HClO4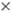 2H2O. 2H2O.
В присут. ингибиторов (CCl3COOH,
C2HCl5, CHCl3 и др.) и при разбавлении водой
термич. стабильность жидкой HClO4 повышается. Распад HClO4
в парах катализируют оксиды переходных металлов (CuO, Fe2O3,
Cr2O3 и др.).
Хлорная к-та хорошо раств.
в CF3COOH, CHCl3, CH2Cl2 и др. хлорир.
углеводородах, однако совмещение ее с р-рите-лями, способными окисляться, как
правило, приводит к воспламенению и взрыву. В безводной HClO4 раств.
ионные П.; при 0 0C р-римость (г в 100 г HClO4): KClO4
4,3, RbClO4 22,6, CsClO4 68,4. П. цезия, Rb, 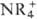 и др. крупных катионов кристаллизуются
из HClO4 в виде нестабильных комплексов M[H(ClO4)2],
легко теряющих молекулу HClO4 в вакууме.
и др. крупных катионов кристаллизуются
из HClO4 в виде нестабильных комплексов M[H(ClO4)2],
легко теряющих молекулу HClO4 в вакууме.
Известны восемь гидратов
HClO4 (табл. 1). Моногидрат 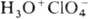 -ионный П.;
-ионный П.; 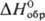 382,0 кДж/моль; в кристал-лич. структуре остальных гидратов присутствуют гидратир.
протоны
382,0 кДж/моль; в кристал-лич. структуре остальных гидратов присутствуют гидратир.
протоны 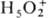 , ,
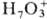 , , 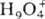 ; входящие в состав кристаллогидратов молекулы воды связаны с ионами
; входящие в состав кристаллогидратов молекулы воды связаны с ионами 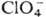 водородными связями. При -25 0C моногидрат переходит в моноклинную
модификацию (пространств. группа Р21/п). Азеотроп с
водой имеет т. кип 203 0C (0,1 МПа) и содержит 72,4% HClO4,
пар над р-рами выше этой концентрации обогащен HClO4, ниже-водой.
водородными связями. При -25 0C моногидрат переходит в моноклинную
модификацию (пространств. группа Р21/п). Азеотроп с
водой имеет т. кип 203 0C (0,1 МПа) и содержит 72,4% HClO4,
пар над р-рами выше этой концентрации обогащен HClO4, ниже-водой.
Хлорная к-та-одна из сильнейших
неорг. к-т, в ее среде соед. даже явно кислотного характера ведут себя как основания,
присоединяя протон и образуя катионы ацилпер-хлоратов, напр. 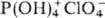 ,
, 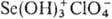 , , 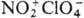 .
В безводной HClO4, а также в р-рах щелочных П. и Cl2O7
в HClO4 возможен синтез П. большинства металлов в несоль-ватир. состоянии. .
В безводной HClO4, а также в р-рах щелочных П. и Cl2O7
в HClO4 возможен синтез П. большинства металлов в несоль-ватир. состоянии.
Конц. HClO4-сильнейший
окислитель, контакт ее с большинством орг. материалов приводит к воспламенению
и взрыву. Окислит. активность к-ты с концентрацией менее 72% значительно ниже,
а термич. устойчивость - выше, чем у 95-100%-ной HClO4.
Водные р-ры HClO4
получают анодным окислением р-ра соляной к-ты или Cl2, р-р, близкий
по составу к дигидра-ту, - ректификацией более разб. р-ров, 100%-ную HClO4-отгонкой
из смеси HClO4·2H2O с олеумом. Водные р-ры HClO4
применяют в аналит. химии для растворения металлов, "влажного сожжения"
орг. в-в и как стандарт в ациди-метрии; как компонент полировальных ванн для
металлов.
Ионные П. П. щелочных и
щел.-зем. металлов -бесцв. кристаллы (табл. 2). П. всех щелочных металлов, кроме
Li, диморфны; при обычных условиях устойчива ромбич. модификация, при высоких
т-рах - кубическая. Перхлорат Sr также диморфен, перхлораты Ca и Ba имеют по
три модификации. Все П., кроме солей К, Rb и Cs, гигроскопичны и образуют гидраты,
напр. Са(СlО4)2·4H2O (т.пл. 75,6 0C),
Sr(ClO4)2·H2O (т.пл. 155 0C).
Табл. 1.- НЕКОТОРЫЕ
СВОЙСТВА HClO4 ·nН2О
* Инконгруэнтно.
Табл. 2.-СВОЙСТВА ПЕРХЛОРАТОВ
ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пространств. группа
низкотемпературной модификации
|
Т-ра поли-морфного
перехода, 0C
|
|
Т-ра начала быстрого
разложения, 0C
|
|
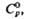
Дж/(моль·К)
|
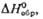
кДж/моль
|
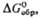
кДж/моль
|
Р-римость в воде
при 25 0C, г в 100 г
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* С разложением.
Табл. 3.-СВОЙСТВА ОНИЕВЫХ
ПЕРХЛОРАТОВ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т-ра медленного
разложения,
|
|
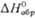
кДж/моль
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ионные П. почти количественно
разлагаются при нагревании до хлорида металла и O2 с промежут. образованием
хлората. В присут. SiO2 и др. термически устойчивых кислотных оксидов
в продуктах распада появляется Cl2. Оксиды переходных металлов, особенно
Ni, Со и Mn, снижают т-ру разложения П. Еще более понижают т-ру разложения ионных
П. оксиды или пероксиды щелочных металлов. П. хорошо раств. в воде и полярных
орг. и неорг. р-рите-лях-спиртах, ацетоне, гидразине, H2O2-
и образуют с ними сольваты. Конц. р-ры П. в окисляемых жидкостях взрывоопасны.
В жидком состоянии П. щелочных и щел.-зем. металлов неограниченно раств. друг
в друге, образуя эвтектики; т-ры плавления эвтектик: 205 0C NaClO4—LiClO4
(71,5 мол. %); 207 0C KClO4—LiClO4 (76,0%);
234 0C Ca(ClO4)2— LiClO4 (76,9%);
293 0C Ca(ClO4)2—NaClO4 (44,9%).
Ион 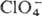 устойчив к действию большинства восстановителей в водном р-ре, количественно
восстанавливается до
устойчив к действию большинства восстановителей в водном р-ре, количественно
восстанавливается до 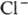 только под действием солей Ti(III), Mo(III) и V(III) в кислой среде. П. металлов
II гр. и нек-рые другие выше 200 0C реагируют с пероксидами и супероксидами
щелочных металлов:
только под действием солей Ti(III), Mo(III) и V(III) в кислой среде. П. металлов
II гр. и нек-рые другие выше 200 0C реагируют с пероксидами и супероксидами
щелочных металлов:
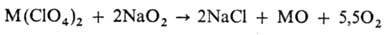 |

