|
ПИРАЗОЛ (1,2-диазол),
мол. м. 68,08; бесцв. кристаллы со своеобразным
запахом; т.пл. 700C, т. кип. 185-1870C; плотн. 1,002 г/см3;
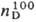 1,4703;
m7,39·10 -30 Кл·м; хорошо раств. в воде, хуже-в бензоле и цикло-гексане
(соотв. 130,18 и 3 г в 100 мл). Обладает слабыми основными св-вами, амфотерен,
рКа 2,47. Молекулы П. плоские и сильно ассоциированы
благодаря водородным связям. Для димера П. характерна
прототропная таутомерия, приводящая к полной идентичности
3- и 5-замещенных: 1,4703;
m7,39·10 -30 Кл·м; хорошо раств. в воде, хуже-в бензоле и цикло-гексане
(соотв. 130,18 и 3 г в 100 мл). Обладает слабыми основными св-вами, амфотерен,
рКа 2,47. Молекулы П. плоские и сильно ассоциированы
благодаря водородным связям. Для димера П. характерна
прототропная таутомерия, приводящая к полной идентичности
3- и 5-замещенных:
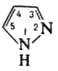
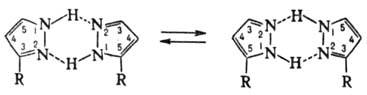
Характер заместителя обычно
влияет на положение тауто-мерного равновесия.
П. обладает ароматич. св-вами,
к-рые связаны с наличием 6p-электронной сопряженной системы. Наиб. электронная
плотность в положении 4, наименьшая - в положениях 3 и 5. Р-ции электроф. замещения
протекают обычно по атому С-4. Алкилирование или ацилирование 1-замещенных П.
приводит к смеси 1,3-
и 1,5-производных. 1-Замещенные П. образуют четвертичные соли по атому N-2,
отщепляющие при нагр. алкильные заместители и распадающиеся при сплавлении со
щелочами до 1,2-диалкилгидразинов:
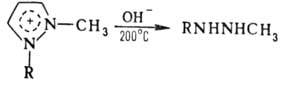
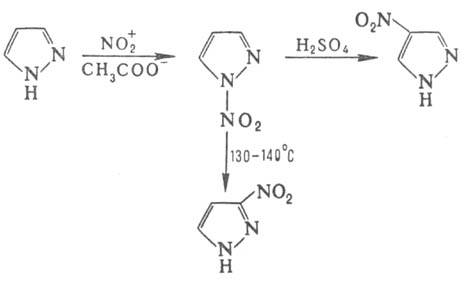
Нитрование П., незамещенных
по атому 1 и содержащих в положении 4 электроноакцепторную группу, приводит
к 1-нитропроизводным, к-рые (если положение 4 свободно) при обработке конц.
H2SO4 дают 4-нитропиразолы, а при нагр. в высококипящем
р-рителе претерпевают 1,5-сигмат-ропную перегруппировку с образованием 3-нитропроизвод-ного:
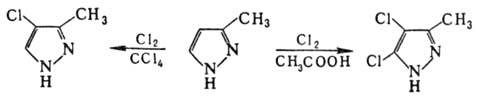
Замещенные П. легко галогенируются
под действием разл. агентов в 4-галогенопроизводные; в более жестких условиях
м. б. получены дигалогенопроизводные, напр.:
Обмен атомов H. на дейтерий
легко протекает в нейтральной среде по положениям 1 и 4, в присут. оснований-по
положениям 3 и 5. Гидрирование П. в присут. Pd (1500C, 10
МПа) или восстановление Na в спирте приводит последовательно к 2-пиразолину
(ф-ла I) и пиразо-лидину(П):
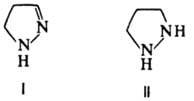
Обратный процесс м. б.
реализован при окислении соед. I и II
действием Br2 , KMnO4, PbO2 , а также в присут.
S или Se при 200-2200C.
Получают П. и его производные
взаимод. гидразина и его производных с 1,3-дикарбонильными соед., напр.:
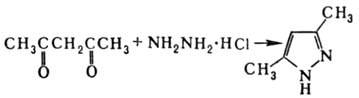
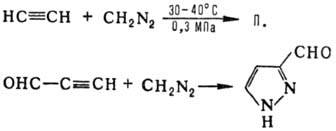
Часто для получения П.
используют также 1,3-диполярное присоединение диазоалканов к ацетиленам, напр.:
Идентифицируют П. в виде
пикрата (т. пл. 1600C) или оксалата (т. пл. 1920C).
П. и его производные-промежут.
продукты в синтезе лек. препаратов (гл. обр. на основе 5-пиразолона - анальгин,
амидопирин, антипирин) и пестицидов; красители для цветной фотографии, орг.
люминофоры.
Лит.. Гетероциклические
соединения, под ред. P. Эльдерфилда, пер. с англ., т. 5, M., 1961; Пожарский
А. Ф., Теоретические основы химии гетеро-циклов, M., 1985; Общая органическая
химия, пер. с англ., т. 8, M., 1985, с. 429-80. Я. И. Грандберг
===
Исп. литература для статьи «ПИРАЗОЛ»: нет данных
Страница «ПИРАЗОЛ» подготовлена по материалам химической энциклопедии.
|

