|
ПЛАВЛЕНИЕ, переход
в-ва из твердого кристаллич. состояния в жидкое при нагр.; фазовый переход первого
рода, происходящий с поглощением теплоты. Главными характеристиками такого перехода
чистых в-в являются т-ра и энтальпия П. Если состав плавящегося в-ва не изменяется,
П. наз. конгруэнтным, если изменяется -ин конгруэнтным.
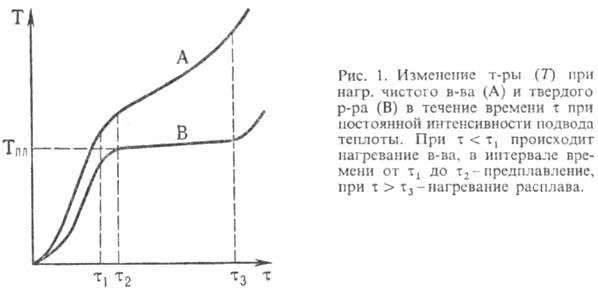
П. предшествуют интенсивное
разупорядочивание кристаллов в-ва (т. наз. предплавление) и проявление жидких
микроучастков на пов-сти кристаллов и вблизи межкристал-литных границ. По мере
нагревания микроучастки укрупняются и сливаются, формируя жидкую фазу, а кристаллы
рассыпаются на фрагменты и уменьшаются в размерах до полного
исчезновения. Теплота, подводимая к в-ву при П., расходуется в осн. на разрыв
межатомных связей, а не на его нагревание. Поэтому чистые крупнокристаллич.
в-ва в течение П. не изменяют свою т-ру (рис. 1). Для таких в-в т-ра П. служит
идентифицирующей характеристикой и критерием их чистоты. П. в-в со сходной кристаллич.
структурой описывается эмпирич. ф-лой Линдемана:
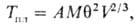
где Тпл-т-ра
П.; А - постоянная для группы в-в; M и V- мол. масса и
объем в-в; q-т-ра Дебая.
Т-ра П. большинства чистых
в-в (за исключением т. наз. аномальных-Bi, Ga, Sb, льда и др.) возрастает с
увеличением давления. Для давлений, меньших 105 Па, зависимость Тпл
от давления p приближенно выражается эмпирич. ф-лой Симона:
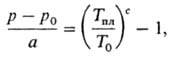
где а и с-постоянные
для данного в-ва (см. табл.); p0 и T0 -
координаты тройной точки (см. Диаграмма состояния).
ПАРАМЕТРЫ ПЛАВЛЕНИЯ
НЕКОТОРЫХ ВЕЩЕСТВ
При p > 105
Па ф-ция Тпл (р)может иметь максимумы (рис. 2). Разница
между т-рами П. полиморфных модификаций одного и того же в-ва достигает 270
К (напр., две кубич. модификации KCl), а кристаллов с разл. изотопным составом-5
К (напр., водород и дейтерий). Крупные кристаллы чистого в-ва плавятся при более
высокой т-ре, чем мелкие. При размерах кристаллов d > 10 нм т-ра их
П. определяется по ф-ле:
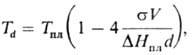
где s-уд. поверхностная
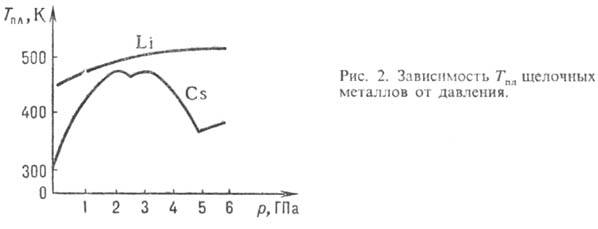
энергия кристаллов; 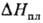 -мол. энтальпия П.
-мол. энтальпия П.
Переход мелкокристаллич.
полидисперсных в-в в жидкое состояние происходит не при постоянной т-ре, а в
интервале т-р (до неск. градусов): начинается при т-ре П. самых мелких, а завершается
при т-ре П. наиб. крупных кристаллов. Твердые р-ры также плавятся в температурном
интервале, к-рый может достигать десятков градусов и в соответствии с диаграммой
состояния зависит от состава этих р-ров. Уд. энтальпия П. большинства в-в находится
в пределах 10-300 кДж/кг и значительно уступает энтальпии парообразования. Возрастание
при П. энтропии 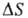 составляет 3-60 Дж/(моль·К); для большинства простых в-в
составляет 3-60 Дж/(моль·К); для большинства простых в-в 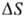 не превышает 6-11 Дж/(моль·К). Связь между изменениями энтальпии, энтропии и
объема в-в при П. и Тпл описывается Клапейрона-Клаузиуса
уравнением.
не превышает 6-11 Дж/(моль·К). Связь между изменениями энтальпии, энтропии и
объема в-в при П. и Тпл описывается Клапейрона-Клаузиуса
уравнением.
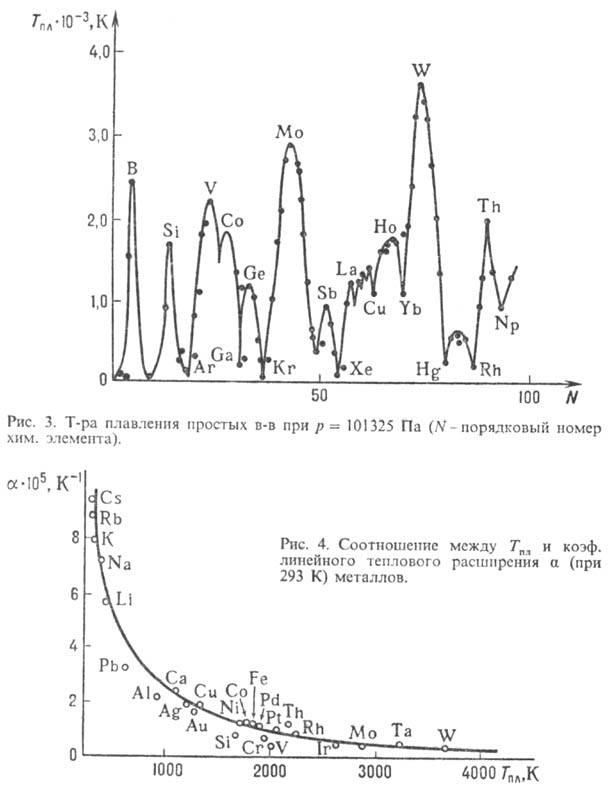
Неорг. простые в-ва плавятся
(рис. 3) при т-рах от 2,0 К (4He) до 3653 К (вольфрам). Среди соединений
наиб. Тпл имеют HfN (3603 К), ZrC (3803 К), TaC (4258 К) и
HfC (4163 К). Т-ра П. металлов коррелирует с их способностью расширяться при
нагр. (рис. 4).
Орг. в-ва плавятся при
80-550 К. Энтальпия П. гомологов увеличивается с ростом мол. массы до предела,
специфичного для каждого гомологич. ряда. В-ва, молекулы к-рых имеют сильно
удлиненную форму, плавятся с переходом в жидкокристаллич. состояние. Кристаллич.
полимеры плавятся в интервале т-р, к-рый определяется MMP и размерами кристаллитов
полимеров.
Наряду с изменениями др.
физ. св-в, при П. увеличивается также уд. объем в-в (кроме аномальных), но резко
снижается сопротивление сдвигу.
П. играет важную роль в
природе (таяние льда и снега на пов-сти Земли, П. минералов с образованием магмы
в ее недрах и т. д.), в науке и технике для литья, пайки, получения чистых в-в
(зонная плавка, П. с фракционной кристаллизацией и др.).
===
Исп. литература для статьи «ПЛАВЛЕНИЕ»: Френкель Я.
И., Кинетическая теория жидкостей. Собр. избр. трудов, т. 3, M.-Л., 1959; Термические
константы веществ. Справочник, под ред. В. П. Глушко, в. 1-10, M., 1965-82;
Уббелоде А., Плавление и кристаллическая структура, пер. с англ., M., 1969;
Физический энциклопедический словарь, M., 1984, с. 535-36. И. В. Мелихов.
Страница «ПЛАВЛЕНИЕ» подготовлена по материалам химической энциклопедии.
|

