|
ПЛАТИНА (исп. platina,
уменьшит. от plata-серебро; лат. Platinum) Pl, хим. элемент VIII гр. периодич.
системы, ат. н. 78, ат. м. 195,08; относится к платиновым металлам. Природная
П. состоит из четырех стабильных изотопов: 194Pt (32,9%), 195Pt
(33.8%), 196Pt (25,2%), 198Pt (7,2%) и двух радиоактивных-190Pt
(0,013%, Т1/2 6,9· 1011 лет), 192Pt
(0,78%, T1/2 1015 лет). Поперечное сечение захвата
тепловых нейтронов для прир. смеси изотопов 8,8 · 10-28 м2.
Конфигурация внеш. электронной оболочки атома 5d96s1;
степени окисления 0, +2, +3, +4, редко +5, +6; энергия ионизации Pt0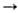 Pt+ Pt+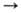 Pt2+ Pt2+
 Pt3+соотв.
9,0, 18,56 и 23,6 эВ; электроотрицательность по Полингу 2,2; атомный радиус
0,138 нм, ионные радиусы (в скобках даны координац. числа) Pt2 +
0,074 нм (4, квадрат) Pt2+ 0,094 нм (6), Pt4+ 0,077
нм (6), Pt5+ 0,071 нм (6). Pt3+соотв.
9,0, 18,56 и 23,6 эВ; электроотрицательность по Полингу 2,2; атомный радиус
0,138 нм, ионные радиусы (в скобках даны координац. числа) Pt2 +
0,074 нм (4, квадрат) Pt2+ 0,094 нм (6), Pt4+ 0,077
нм (6), Pt5+ 0,071 нм (6).
П.-один из наиб. редких
элементов, его средняя концентрация в земной коре 5· 10-7 % по массе.
Встречается в самородном виде, в виде сплавов и соединений. Наиб. важные минералы-самородная
П., поликсен (содержит 6-10% Fe), палладистая П. (60-90% П., 7-39% Pd), ферро-платина
(12-20% Fe), иридистая П. (55-60% П., до 30% Ir), сперрилит PtAs2,
куперит PtS, брэггит (Pt, Pd, Ni)S. Наиб. значит. месторождения П. сосредоточены
в ЮАР и СССР (сульфидные руды Норильского района и Кольского п-ова).
Свойства. П.-серовато-белый
блестящий пластичный металл; кристаллизуется в гранецентрир. кубич. решетке,
а = 0,392 нм, z = 4, пространств. группа Fт3т; т. пл. 1769
0C, т.кип. ок. 38000C; плотн. 21,45 г/см3;
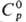 25,85 Дж/(моль·
К); 25,85 Дж/(моль·
К);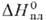 20 кДж/моль, 20 кДж/моль,
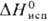 510 кДж/моль; 510 кДж/моль;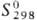 41,6 Дж/(моль· К); температ.урный коэф. линейного расширения 9,1 · 10-6
К-1 (273-373 К); r 9,85 мкОм· см (00C); теплопроводность
74,1 Вт/(м·К); парамагнетик, уд. магн. восприимчивость +9,71 ·10-7
(200C); работа выхода электрона 5,23 эВ. Твердость по Бринеллю 390-420;
модуль упругости 173 ГПа, твердость по Виккерсу 38-40. В горячем состоянии П.
хорошо прокатывается и сваривается. Холодное деформирование упрочняет П., относительное
удлинение уменьшается от 30-50 до 1-2%, а твердость по Виккерсу увеличивается
до 90-95. Отжиг П. приводит к восстановлению ее пластичности. Легирующие добавки
обычно увеличивают прочность и твердость П.
41,6 Дж/(моль· К); температ.урный коэф. линейного расширения 9,1 · 10-6
К-1 (273-373 К); r 9,85 мкОм· см (00C); теплопроводность
74,1 Вт/(м·К); парамагнетик, уд. магн. восприимчивость +9,71 ·10-7
(200C); работа выхода электрона 5,23 эВ. Твердость по Бринеллю 390-420;
модуль упругости 173 ГПа, твердость по Виккерсу 38-40. В горячем состоянии П.
хорошо прокатывается и сваривается. Холодное деформирование упрочняет П., относительное
удлинение уменьшается от 30-50 до 1-2%, а твердость по Виккерсу увеличивается
до 90-95. Отжиг П. приводит к восстановлению ее пластичности. Легирующие добавки
обычно увеличивают прочность и твердость П.
По хим. св-вам П. близка
к Pd, но несколько превосходит его по хим. устойчивости. При нагр. на воздухе
или в атмосфере O2 П. окисляется с образованием летучих оксидов.
Один объем платиновой черни поглощает до 100 объемов O2. П. медленно
раств. в горячей H2SO4 и жидком Br2, раств.
в царской водке. Не взаимод. с другими минер. и орг. к-тами. При нагр. реагирует
со щелочами, Na2O2, галогенами, S, Se, Те, P, С, Si. Поглощает
H2, хотя в этом отношении уступает Pd, Ir и Ru; удаление поглощенного
H2 из П. нагреванием в вакууме затруднено.
С кислородом П. образует
красновато-коричневый три-оксид PtO3 (м. б. пероксид), коричневый
диоксид PtO2 и черный оксид PtO, разлагающиеся соотв. при комнатной
т-ре, при 380-4000C и при 5600C. PtO3 окисляет
HCl до Cl2; получают анодным окислением. PtO2 образует
неск. гидратов; получают гидролизом PtCl4. PtO синтезируют окислением
порошкообразной П. в O2 или термич. разложением Pt(OH)2,
к-рый осаждают из р-ров при щелочном гидролизе хлороплатинатов(П). Окислением
П. в разл. условиях получены также Pt2O3 и Pt3O4,
гидролизом хлоропла-тинатов(IV) - Pt(OH)4.
Гексафторид PtF6
- темно-красные кристаллы; т. пл. 69,40C, т.возг. 690C;
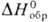 -676 кДж/моль
(для газа); сильнейший окислитель, реагирует с Xe, O2 и NO, образуя
соотв. XePtF6, O2PtF6, NOPtF6; получают
фторированием П. при 950-1000 0C, под давлением-при 200 0C
или с использованием атомного фтора. Темно-красный пентафторид PtF5
получают фторированием П. при 3500C, светло-коричневый тетрафторид
PtF4 (разлагается выше 3000C, плотн. 7,07 г/см3, -676 кДж/моль
(для газа); сильнейший окислитель, реагирует с Xe, O2 и NO, образуя
соотв. XePtF6, O2PtF6, NOPtF6; получают
фторированием П. при 950-1000 0C, под давлением-при 200 0C
или с использованием атомного фтора. Темно-красный пентафторид PtF5
получают фторированием П. при 3500C, светло-коричневый тетрафторид
PtF4 (разлагается выше 3000C, плотн. 7,07 г/см3,
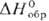 -410 кДж/моль)-фторированием
П. при 2000C. Желтый трифторид состава PtII [PtIVF6]
получают в смеси с др. фторидами при фторировании П. Все фториды П. гигроскопичны
и разлагаются водой. Известны окси-фториды П. и фтороплатинаты(IV, V и VI). -410 кДж/моль)-фторированием
П. при 2000C. Желтый трифторид состава PtII [PtIVF6]
получают в смеси с др. фторидами при фторировании П. Все фториды П. гигроскопичны
и разлагаются водой. Известны окси-фториды П. и фтороплатинаты(IV, V и VI).
Красновато-коричневый тетрахлорид
PtCl4 разлагается при 370 0C даже в атмосфере Cl2;
образует гидраты с 1, 4, 5 и 7 молекулами воды и платинохлористоводородные к-ты
(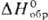 PtCl4·5H2O
-1748 кДж/моль, H[PtCl5]· 2H2O -1013
кДж/моль, H2[PtCl6]· 6H2O -2363 кДж/моль);
хорошо раств. в воде и ацетоне; получают хлорированием П. при 250-3000C,
разложением H2PtCl6 · 6H2O при 3000C.
Диxлорид PtCl 2 ( PtCl4·5H2O
-1748 кДж/моль, H[PtCl5]· 2H2O -1013
кДж/моль, H2[PtCl6]· 6H2O -2363 кДж/моль);
хорошо раств. в воде и ацетоне; получают хлорированием П. при 250-3000C,
разложением H2PtCl6 · 6H2O при 3000C.
Диxлорид PtCl 2 (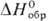 -107 к Дж/моль) существует в двух формах - нерастворимой в воде оливково-зеленой
(a) и красноватой (b); разлагается при 580 0C в атмосфере Cl2;
при растворении в слабой соляной к-те образует H2[PtCl4],
в водных р-рах NН3-аммин [Pt(NH3)2Сl2].
Известны также аддукты типа PtCl2· 2PCl3 (т.пл. 1600C),
PtCl2· 2PF3 (т.пл. 1020C); получают PtCl2
хлорированием П. выше 5000C, разложением H2[PtCl6]·
6H2O при 360-3800C. Существуют многочисленные хлороплатинаты(IV
и II): MI2[PtCl6] и MI2[PtCl4],
напр. гексахлорплатинат (IV) аммония (NH4)2 [PtCl6
] - желтые кристаллы;
-107 к Дж/моль) существует в двух формах - нерастворимой в воде оливково-зеленой
(a) и красноватой (b); разлагается при 580 0C в атмосфере Cl2;
при растворении в слабой соляной к-те образует H2[PtCl4],
в водных р-рах NН3-аммин [Pt(NH3)2Сl2].
Известны также аддукты типа PtCl2· 2PCl3 (т.пл. 1600C),
PtCl2· 2PF3 (т.пл. 1020C); получают PtCl2
хлорированием П. выше 5000C, разложением H2[PtCl6]·
6H2O при 360-3800C. Существуют многочисленные хлороплатинаты(IV
и II): MI2[PtCl6] и MI2[PtCl4],
напр. гексахлорплатинат (IV) аммония (NH4)2 [PtCl6
] - желтые кристаллы; 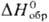 — 984,1 кДж/моль; плохо раств. в воде, разлагается при нагр. до металла.
— 984,1 кДж/моль; плохо раств. в воде, разлагается при нагр. до металла.
Коричневато-черный тетрабромид
PtBr4 (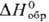 —159 кДж/моль) медленно разлагается при 1800C; его получают из простых
в-в при 150 0C или выпариванием р-ра П. в смеси HNO3 и
HBr. Коричневый дибромид PtBr2 (
—159 кДж/моль) медленно разлагается при 1800C; его получают из простых
в-в при 150 0C или выпариванием р-ра П. в смеси HNO3 и
HBr. Коричневый дибромид PtBr2 (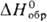 -100 кДж/моль) разлагается
при 2500C. Коричневато-черный тетраиодид PtI4 (
-100 кДж/моль) разлагается
при 2500C. Коричневато-черный тетраиодид PtI4 (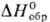 - 59,4 к Дж/моль) разлагается при 1300C; его получают из простых
в-в или осаждают действием KI на р-р H2PtCl6. Черный дииодид
PtI2 разлагается при 3600C.
- 59,4 к Дж/моль) разлагается при 1300C; его получают из простых
в-в или осаждают действием KI на р-р H2PtCl6. Черный дииодид
PtI2 разлагается при 3600C.
Серовато-черные сульфид
PtS (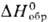 —83,09 кДж/моль) и дисульфид PtS2 (
—83,09 кДж/моль) и дисульфид PtS2 (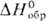 -112 кДж/моль, разлагается при 225-250 0C) не раств. в воде и м.
б. получены взаимод. П. с S, дисульфид - также осаждением H2S из
р-ров гексахлороплатинатов(IV). Близкими св-вами обладают селенид PtSe2
и теллуриды PtTe и PtTe2.
-112 кДж/моль, разлагается при 225-250 0C) не раств. в воде и м.
б. получены взаимод. П. с S, дисульфид - также осаждением H2S из
р-ров гексахлороплатинатов(IV). Близкими св-вами обладают селенид PtSe2
и теллуриды PtTe и PtTe2.
Сульфаты П. легко гидролизуются,
в присут. хлорид-ионов легко переходят в хлориды и хлороплатинаты.
П. в степени окисления
+2 и +4 образует многочисл. комплексные соед., по составу близкие к соед. Pd.
Наиб. многочисленны соед. [PtX4]2- и [PtX6]2-
(X = F, Cl, Br, I). Получены комплексные соед. Pt0, напр. Pt(PF3)4
(т. пл. 15 0C, т. кип. ок. 870C). Известны также разл.
аммины, разно-лигандные комплексы, соед. с орг. лигандами, моно- и полиядерные
комплексы и т.д. См. также Платинаоргани-ческие соединения.
Получение. Шлиховую
П., лом или концентраты платиновых металлов растворяют в царской водке, после
чего добавляют этанол и сахарный сироп для удаления избытка HNO3
и восстановления иридия и палладия до Ir3+ и Pd2 +
. Далее осаждают (NH4)2PtCl6 действием NH4Cl,
осадок высушивают и прокаливают при постепенном повышении т-ры до 800-10000C
с получением загрязненной губчатой П. Чистую П. получают растворением этого
продукта в царской водке, повторным осаждением и прокаливанием. Губчатую П.
переплавляют. При восстановлении солей П. в р-рах образуется мелкодисперсная
П.-платиновая чернь. Для получения платиновых покрытий (платинирование) используют
фосфатные или цис-диамминонитритные электролиты.
Применение. Осн.
области применения П., ее сплавов и соед.- автомобилестроение (в развитых странах
потребляется от 30 до 65% П.), электротехника и электроника (7-13%), нефтехимия
и орг. синтез (7-12%), стекольная и керамич. пром-сть (3-17%), произ-во ювелирных
изделий (2-35%). Применение катализаторов дожигания выхлопных газов автомобилей
[сплав Pt-Pd (70-30%)] началось в сер. 70-х гг. и быстро расширялось в связи
с ужесточением требований к охране атм. воздуха. В электротехнике и электронике
П. используют как материал контактов электрич. приборов и печей сопротивления.
Так, для контактов высоковольтных реле применяют сплавы П. с Ir и Ru. П. и ее
сплавы с Ir и Re в нефтехимии применяют для повышения октанового числа бензина,
в орг. синтезе-как катализаторы гидрирования, изомеризации, циклизации, окисления.
С помощью таких катализаторов производят, напр., бензол, толуол, ксилол.
П. используют для каталитич.
синтеза HNO3, H2SO4, ката-литич. очистки H2.
Платиновые катализаторы используют в виде сеток, черней и нанесенными на носители.
В стекольной пром-сти П.
с добавками Rh и Ir-осн. конструкц. материал стекловаренных печей для произ-ва
оптич. стекла. Из сплавов с Rh и Au изготовляют фильеры для получения стекловолокна,
а также футеровку для печей, краски для керамики и стекла. П. применяют в качестве
материала высокотемпературных термопар и термометров сопротивления, электродов
при электролизе, для изготовления лаб. посуды и оборудования, в зубоврачебном
деле. Сравнительно новые области применения П.-изготовление катализаторов для
топливных элементов, создание противоопухолевых препаратов [цис-Pt(NH3)2Cl2],
произ-во контейнеров для радиоизотопных генераторов.
В сер. 80-х гг. ежегодная
добыча П. в капиталистич. и развивающихся странах составляла 60-75 т, а извлечение
из вторичных источников-ок. 5-10 т.
===
Исп. литература для статьи «ПЛАТИНА»: Платина, ее
сплавы и композиционные материалы, M., 1980. См. также лит. при ст. Платиновые
металлы.
Страница «ПЛАТИНА» подготовлена по материалам химической энциклопедии.
|

