|
АРГОН (от греч. argos - недеятельный; лат Argon) Ar, хим. элемент
VIII гр. периодич. системы, относится к благородным газам, ат. н. 18, ат.
м. 39,948. Прир. А. состоит из изотопов с мас. ч. 36 (0,337% по объему),
38 (0,063%), 40 (99,600%), т.е., в отличие от др. легких элементов, преобладает
самый тяжелый изотоп. Причина этого - концентрирование 40Аг
в атмосфере в результате распада в литосфере 40К посредством
захвата орбитального электрона: К + + е -> 40Аг+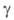 (превращ. 12% 40К). Поперечное сечение захвата тепловых нейтронов
для прир. А. 62*10-26 м2. Конфигурация внеш. электронной
оболочки 3s23p6; энергия ионизации Аг° -> Аг+
-> Аг2+ соотв. 1520,57 и 2665,83 кДж/моль; ван-дер-ваальсов
радиус 0,192 нм, ковалентный радиус 0,095 нм.
(превращ. 12% 40К). Поперечное сечение захвата тепловых нейтронов
для прир. А. 62*10-26 м2. Конфигурация внеш. электронной
оболочки 3s23p6; энергия ионизации Аг° -> Аг+
-> Аг2+ соотв. 1520,57 и 2665,83 кДж/моль; ван-дер-ваальсов
радиус 0,192 нм, ковалентный радиус 0,095 нм.
А. - самый распространенный из благородных газов элемент. В атмосфере
его содержится 0,934% по объему (4*1014т), в литосфере - 4*10-6%
по массе.
А. - одноатомный газ без цвета и запаха; т. кип. 87,29 К; плотн. 0,001784
г/см3 (жидкого при 87 К - 1,40 г/см3, твердого при
40 К -1,40 г/см3); ркрит 0,4894 МПа; dкрит
0,536 г/см3; тройная точка: т-ра 83,81 К, давл. 68,9 кПа, плотн.
1,623 г/см3; Сp° 20,79 Дж/(моль*К);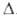 Нопл
1,17 кДж/моль, Нопл
1,17 кДж/моль,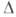 Н°исп
6,51 кДж/моль; S298 154,73 ДжДмоль*К); ур-ния температурной
зависимости давления пара над твердым и жидким А. соотв.: lgp(Па)
= -404,84/Т + 9,66944, 1gр(Па) = - 550,8211/Т - 8,784939 lg Т +
0,0174713 Т + + 26,8435. Теплопроводность 0,0164 Вт/(м*К); е 1,000554 (273,15
К, 0,10133 МПа). Диамагнетик; магн. восприимчивость (-19,4*10-6)
не зависит от т-ры. Р-римость в воде при нормальном давлении (см3/л):
52,4 (273 К), 33,6 (293 К), 24,9 (313 К), 20,8 (333 К), 18,1 (353 К). В
орг. р-рителях А. раств. значительно лучше, чем в воде. Для твердого А.
кристал-лич. решетка кубич. гранецентрированная (а = 0,542 нм, z
= = 4, пространств, группа Fm3m). Н°исп
6,51 кДж/моль; S298 154,73 ДжДмоль*К); ур-ния температурной
зависимости давления пара над твердым и жидким А. соотв.: lgp(Па)
= -404,84/Т + 9,66944, 1gр(Па) = - 550,8211/Т - 8,784939 lg Т +
0,0174713 Т + + 26,8435. Теплопроводность 0,0164 Вт/(м*К); е 1,000554 (273,15
К, 0,10133 МПа). Диамагнетик; магн. восприимчивость (-19,4*10-6)
не зависит от т-ры. Р-римость в воде при нормальном давлении (см3/л):
52,4 (273 К), 33,6 (293 К), 24,9 (313 К), 20,8 (333 К), 18,1 (353 К). В
орг. р-рителях А. раств. значительно лучше, чем в воде. Для твердого А.
кристал-лич. решетка кубич. гранецентрированная (а = 0,542 нм, z
= = 4, пространств, группа Fm3m).
С водой, фенолом, гидрохиноном и ацетоном А. образует соед. включения,
а с электроотрицат. атомами в электрич. разряде или под действием пучка
электронов - эксимеры (см. Благородные газы).
Получают А. в результате воздуха разделения при глубоком охлаждении.
Обогащенная А. смесь, содержащая до 40% О2, подается на разделение
в колонну. В результате получают 95%-ный А.; степень извлечения достигает
0,75-0,80. Дальнейшая очистка от О2 осуществляется ги-дрированием
в присут. платинового кат. при 333-343 К, а от N2 - низкотемпературной
ректификацией. Применяется также адсорбц. метод очистки (от О2,
Н2 и др. благородных газов) с использованием активного угля
или молекулярных сит. А. может быть получен и как побочный продукт из продувочных
газов в колоннах для синтеза NH3.
Качественно А. обнаруживают с помощью эмиссионного спектрального анализа;
осн. характеристич. линии - 434,80 и 811,33 нм. При количеств, определении
сопутствующие газы (О2, N2, H,, СО2) связываются
специфич. реагентами (Са, Си, MnO, CuO, NaOH) или отделяются с помощью
поглотителей (напр., водных р-ров орг. и неорг. сульфатов). Отделение от
других благородных газов основано на разл. адсорбируемости их активным
углем. Используются методы анализа, основанные на измерении плотности,
теплопроводности и др., а также масс-спектрометрич. и хроматографич. методы.
А. используют в кач-ве защитной среды при сварке (60-65% получаемого
А.), получении металлов и в др. металлургич. процессах (30-35%), в произ-ве
полупроводниковых материалов, при хим. синтезах. А. применяют также как
наполнитель в светотехнике (в разрядных трубках, люминесцентных лампах;
2-3%), электронике (в тиратронах и др.), ядерной технике (в ионизац. счетчиках
и др.). Мировое произ-во А. (без СССР) 5*108-5*109
м3/год.
А. при давл. 0,4 МПа вызывает у человека оцепенение, нервно-мышечные
расстройства и затуманенность мышления.
А. поставляется, транспортируется и хранится в стальных баллонах емкостью
40 л; давление газа в баллоне до 15 МПа. Баллоны для чистого А. окрашены
в серый цвет и имеют сверху зеленую полосу, верх. часть баллона для А.
особой чистоты окрашена в белый цвет, нижняя - в черный. А. особой чистоты
хранится также в стеклянных баллонах емкостью 2 л под давл. 0,06-0,07 МПа.
А. открыт Дж. Рэлеем и У. Рамзаем в 1894.
Лит. см. при ст. Благородные газы. В. Б. Соколов.
===
Исп. литература для статьи «АРГОН»: нет данных
Страница «АРГОН» подготовлена по материалам химической энциклопедии.
|

