|
ПОЛИФТОРАРОМАТИЧЕСКИЕ
СОЕДИНЕНИЯ, содержат, как правило, не более двух заместителей (включая
Н), отличных от фтора.
П. с. устойчивы к действию
влаги, воздуха, трудногорючи, взрывобезопасны. Атомы F повышают кислотность
П. с., напр. рКа для C6F5COOH и С6Н5СООН
соотв. 1,75 и 4,20.
В отличие от нефторир.
ароматических соединений для П. с. наиб. характерны р-ции нуклеоф. замещения,
напр.:
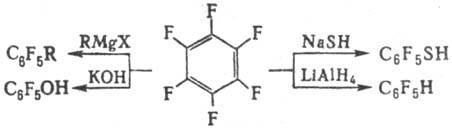
Заместители OR, СН3,
Н, Hal, CN и др. в ядре П.с.-пара-ориентанты; сильные доноры электронов-NH2,
ОН-мета-ориентанты; заместители, способные к образованию с нуклеоф. реагентом
водородной связи или комплекса донорно-акцепторного типа (NO2, COOH,
SO2R), в малополярных р-рителях ориентируют замещение преим. в орто-положение,
а в апротонных диполярных - в пара-положение. В октафторнафталине замещение
идет только в р-положение.
Р-ция П. с. с электроф.
реагентами протекает обычно в более жестких условиях, чем с нефторир. аналогами
с образованием продуктов электроф. присоединения; для водородсодержащих П. с.
возможно также электроф. замещение (галогенирование, сульфирование, нитрование,
алки-лирование и ацилирование по Фриделю-Крафтсу). Направление р-ции зависит
от строения полифторароматич. соед., природы электрофильного реагента и растворителя,
напр.:
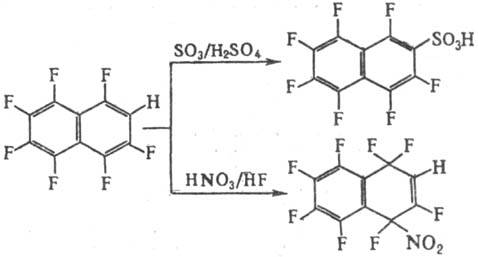
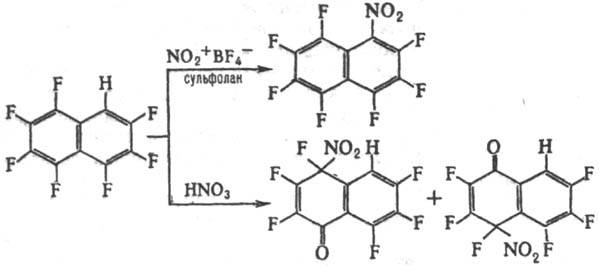
П. с. вступают в р-ции
радикального присоединения и замещения с образованием гл. обр. димеров радикальных
а-комплексов (см. Гексафторбензол).
Р-ции П. с. с дифторкарбенами
(570-770 °С) приводят, в зависимости от характера заместителей, к разл.
соед., напр.:
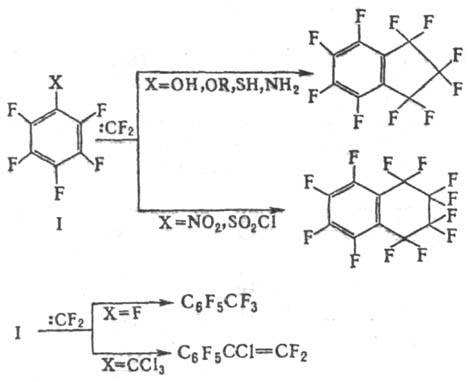
Однако с метиленом гексафторбензол
реагирует с расширением цикла.
П. с. могут вступать в
фотохим. р-ции; в частности, при фотолизе гексафторбензол превращ. в стабильный
гексафторбензол Дьюара, а в присут. олефинов дает продукты присоединения или
циклоприсоединения, напр.:
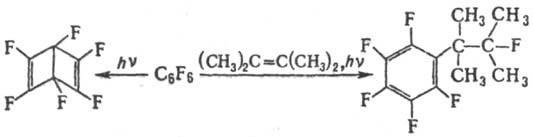
Осн. методы синтеза: взаимод.
полихлорароматич. соединений с KF при 300-500 °С без р-рителя или при 150-300
°С в сульфолане, диметилформамиде, бензонитриле; пиролиз хладонов (CBr3F,
CHC12F/CH2C1F); фторирование арома-тич. углеводородов
или их хлорпроизводных с послед. дегидрогалогенированием или дегалогенированием
полученных алициклич. соединений.
Применяют П. с. как р-рители,
а также для синтеза лек. ср-в, пестицидов, термо- и радиационностойких пластмасс,
каучуков, лаков, клеев, масел, смазок и др.
См. также Пентафторанилин,
Пентафторфенол, Пента-фторхлорбензол.
===
Исп. литература для статьи «ПОЛИФТОРАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ»: Реакционная
способность полифторароматических соединений, под ред. Г. Г. Якобсона, Новосиб.,
1983; Штейнгарц В. Д., в кн.: Вопросы органической химии, в. 2, Л., 1984,
с. 112-37. А. Ю. Волконский.
Страница «ПОЛИФТОРАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.
|

