|
ПОЛЯ ЛИГАНДОВ ТЕОРИЯ,
квантовохим. теория электронного строения координац. соединений. Описывает
взаимодействие центр. атома (или группы атомов) и лигандов на основе представлений
о мол. орбиталях в рамках молекулярных орбиталей методов. Как и в кристаллического
поля теории, в П. л. т. принимается, что состояние электронов центр. атома
определяется электростатич. полем, созданным лигандами, однако учитывается также
изменение электронного распределения лигандов под воздействием центр. атома.
Соотв. расширяются и задачи, решаемые методами П. л. т.: помимо описания строения,
реакц. способности, расчета спектральных и термодинамич. характеристик координац.
соединений и изменений их св-в при замене центр, атома или, лигандов, становится
возможным теоретич. анализ таких ситуаций, когда взаимодействие центр. атома
и лигандов настолько существенно, что может привести, напр., к образованию прочных
хим. связей. Так, П. л. т. позволяет, в частности, описать смещения электронной
плотности s- и p-электронных подсистем в группах СО карбонильных комплексов
металлов.
Согласно П. л. т., изменение
электронного распределений в комплексном соед. по сравнению со свободными (изолированными)
центр. атомом и лигандами наиб. существенно для валентной оболочки центр. атома,
высших заполненных и низших незаполненных (виртуальных) орбиталей лигандов;
именно из этих орбиталей конструируются мол. орби-тали комплекса в целом. Остальные
орбитали центр. атома и лигандов считаются неизменными. Эксперим. результаты,
получаемые методами фотоэлектронной и рентгеновской спектроскопии, а также расчеты
с помощью неэмпирических методов квантовой химии свидетельствуют о том,
что потенциалы ионизации с внутр. орбиталей комплексов и электронные распределения
зависят от природы лигандов. Однако при описании электронного строения валентной
оболочки комплекса этой зависимостью можно пренебречь. П. л. т. наиб. плодотворна
для анализа комплексных соед., образованных d- и f-элементами,
в частности переходными металлами, для к-рых характерна близость расположения
атомных уровней типа 3d, 4s и 4р.
Расположение энергетич.
уровней комплекса и его орбитали можно определить непосредственно одним из методов
мол. орбиталей (наиб. надежные результаты получают при применении метода самосогласованного
поля ССП-Хa) либо рассчитать приближенно, напр. в предположении,
что изменение взаимодействия орбиталей центр. атома и лигандов в зависимости
от геом. расположения лигандов м. б. описано с использованием лишь угловой части
интегралов перекрывания (см. Молекулярные интегралы). Радиальная часть
интегралов перекрывания более чувствительна к расстояниям между центр. атомом
и лигандами, поэтому изменение радиальной части обычно связывают с нек-рыми
эффективными параметрами, характеризующими степень ковалентности связи. На рис.
показана рассчитанная схема расположения энергетич. уровней октаэдрич. комплекса
XY6, образованного d-элементом; возле каждого уровня указан
тип симметрии орбиталей. Для обозначенных уровней t2u,
t1g, t1u (жирные линии)
корреляция p-орбита-лей лигандов и орбиталей центр. атома мала. Приведенная
картина типична и напоминает в осн. чертах систему уровней, получаемую на основе
теории кристаллич. поля.
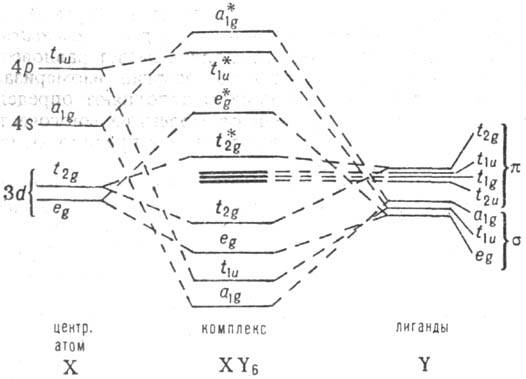
Схема энергетич. уровней
октаэдрич. комплекса XY6. Пунктирные линии обозначают корреляцию
орбиталей центр. атома X с s- и p-орбиталями лигандов Y. При уровнях
энергии указан тип симметрии орбиталей; звездочкой отмечены разрыхляющие орбитали.
С помощью указанной схемы
энергетич. уровней можно, напр., описать низшие электронные состояния комплекса
TiCl63- , если учитывать лишь валентные орбитали атома
Ti (4 валентных электрона), а для каждого из атомов С1-по одной s-орбитали
и по две p-орбитали (5 валентных 2p-электронов для каждого атома).
Все 37 электронов располагают в соответствии с принципом Паули на одноэлект-ронных
уровнях так, чтобы энергия системы была минимальной. Как и в теории кристаллич.
поля, различают случаи сильного, слабого и среднего поля, сравнивая интенсивность
поля лигандов с энергией межэлектронного отталкивания. Для анализируемого комплекса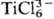 имеет
место случай сильного поля. Если учесть вырождение энергетич. уровней (для уровней
типа a1g кратность вырождения равна 1, типа
еg-2, типов t1g, t1u,
t2g и t2u-3), основное
состояние этого комплекса можно описать электронной конфигурацией имеет
место случай сильного поля. Если учесть вырождение энергетич. уровней (для уровней
типа a1g кратность вырождения равна 1, типа
еg-2, типов t1g, t1u,
t2g и t2u-3), основное
состояние этого комплекса можно описать электронной конфигурацией 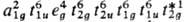 .
Для комплекса в целом эта электронная конфигурация определяет состояние типа
2Т2g, т.к. полностью заполненные оболочки
не дают вклада в мультиплетность и симметрию состояния. .
Для комплекса в целом эта электронная конфигурация определяет состояние типа
2Т2g, т.к. полностью заполненные оболочки
не дают вклада в мультиплетность и симметрию состояния.
В рассмотренном примере
ион С1 можно представить условно точечным зарядом, определяющим поле, в к-ром
движется единств. электрон иона Ti3+ , поэтому результаты, полученные
на основе П. л. т. и теории кристаллич. поля, качественно совпадают. Однако
количеств. оценки, напр. для потенциалов ионизации, рассчитанных на основе Куп-манса
теоремы, или для энергии электронных переходов 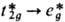 в низшее возбужденное состояние комплекса, существенно различаются. В хелатных,
"сэндвичевых" соед., координационных соед. с p-связями лиганды
- металл и во мн. др. комплексах с легко поляризуемыми лигандами электронное
состояние лигандов и центр. атома нельзя определять как обусловленное воздействием
поля системы точечных зарядов. В таких случаях применима лишь П. л. т., но не
теория кристаллич. поля. То же относится к проблемам исследования перераспределения
спиновой плотности методами ЭПР и анализа взаимодействия электронных и колебат.
движений в молекуле (см. Яна-Теллера эффект). П. л. т. позволяет
объяснить транс-эффект при замещении лигандов, взаимное влияние лигандов
на реакц. способность комплекса и т.п.
в низшее возбужденное состояние комплекса, существенно различаются. В хелатных,
"сэндвичевых" соед., координационных соед. с p-связями лиганды
- металл и во мн. др. комплексах с легко поляризуемыми лигандами электронное
состояние лигандов и центр. атома нельзя определять как обусловленное воздействием
поля системы точечных зарядов. В таких случаях применима лишь П. л. т., но не
теория кристаллич. поля. То же относится к проблемам исследования перераспределения
спиновой плотности методами ЭПР и анализа взаимодействия электронных и колебат.
движений в молекуле (см. Яна-Теллера эффект). П. л. т. позволяет
объяснить транс-эффект при замещении лигандов, взаимное влияние лигандов
на реакц. способность комплекса и т.п.
Ограничения П. л. т. относятся
прежде всего к анализу возбужденных состояний комплексов (особенно в случае
средних и слабых полей лигандов). В этих случаях для получения надежных данных
о распределении электронов в комплексах следует учитывать не только расположение
и порядок одноэлектронных уровней энергии, но и корреляц. эффекты, обусловленные
межэлектронным отталкиванием. При анализе комплексов, образованных тяжелыми
металлами, необходим учет спин-орбитального взаимодействия и нек-рых
др. эффектов.
===
Исп. литература для статьи «ПОЛЯ ЛИГАНДОВ ТЕОРИЯ»: Бальхаузен
К., Введение в теорию поля лигандов, пер. с нем., М., 1964; Берсукер И. Б.,
Электронное строение и свойства координационных соединений,
2 изд., Л., 1976; Современные проблемы квантовой химии. Строение и свойства
молекул, Л., 1986; Левин А. А., ДьячковП. Н., Электронное строение, структура
и превращения гетеролигандных молекул, М., 1990; Степанов Н. Ф., Пупышев В.
И., Квантовая механика молекул и квантовая химия, М., 1991. В. И. Пупышев.
Страница «ПОЛЯ ЛИГАНДОВ ТЕОРИЯ» подготовлена по материалам химической энциклопедии.
|

